
分析 (1)根据萃取剂选择的原则及萃取实验用到的玻璃仪器解答;
(2)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,根据转移电子守恒、原子守恒配平方程式;
(3)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
解答 解:(1)根据萃取剂选择的原则可知萃取剂与水不互溶,所以W不能溶于水,萃取实验用到的玻璃仪器有:分液漏斗、烧杯、玻璃棒、量筒,所以还缺少的是分液漏斗;
故答案为:不能;分液漏斗;
(2)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,则O元素化合价由-1价变为-2价,转移电子数为2,根据电荷守恒知未知微粒是氢离子,根据转移电子守恒、原子守恒配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,
故答案为:2,1,6H2O,2Ce(OH)4↓,6H+;
(3)根据电子守恒可得关系:Ce(OH)4~FeSO4,
0.6240g样品中含有Ce(OH)4的物质的量为:0.1000mol/L×0.02910L,
所以产品中Ce(OH)4的质量分数为:$\frac{0.1000mol/L×0.02910L}{0.624g}$×100%=97.00%;
故答案为:97.00%.
点评 本题为综合题,涉及萃取实验、氧化还原方程式配平、有关方程式计算,明确萃取实验过程及仪器,明确氧化还原反应得失电子守恒规律是解题关键,题目难度中等.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| | | G | | X |
| R | T | Y |
| A. | R和Y组成的化合物水溶液呈中性 | |
| B. | 最高价氧化物的水化物酸性:Y>G>X>R | |
| C. | 简单氢化物稳定性:X>Y>T | |
| D. | 常温下,TX4、TY4都呈液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氯化物是离子化合物 | B. | 其最高价氧化物水化物为一种弱碱 | ||
| C. | 它比Ca更易置换水中的氢 | D. | 它的碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
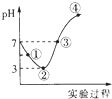 常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入100mL的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | ①处c(H+)约为②处c(H+)两倍 | |
| B. | 曲线③④段有离子反应:HClO+OH-═H2O+ClO- | |
| C. | 可以依据②处数据计算所得溶解的氯气的量n(Cl2) | |
| D. | ③处表示氯气与氢氧化钠恰好反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| Z | W |
| A. | 若HmXOn为强酸,则Y的氢化物溶于水显酸性(m、n均为正整数) | |
| B. | 若W(OH)n为两性氢氧化物,则Z(OH)m为强碱(m、n均为正整数) | |
| C. | 若气体XHn不溶于水,则HmWOn为强酸(m、n、a均为正整数) | |
| D. | 若HmZOn为强酸,则气体HnY易溶于水(m、n、a均为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
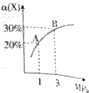 在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
在一定条件下,反应X(g)+3Y(g)?2Z(g)△H=-92.4kJ•mol-1,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 图中A、B两点,达到相同的平衡体系 | |
| B. | 上述反应在达到平衡后增大压强,X的转化率提高 | |
| C. | 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小 | |
| D. | 将1.0molX,3.0molY,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲快 | B. | 乙快 | C. | 相等 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 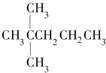 | B. | CH3CH2CH2CH2CH3 | C. | 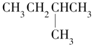 | D. | 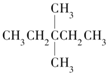 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com