
分析 (1)硫酸与氢氧化钾反应生成硫酸钾和水;
(2)碳酸钠与醋酸反应生成醋酸钠、二氧化碳气体和水;
(3)大理石的主要成分为碳酸钙,碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水;
(4)氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙.
解答 解:(1)硫酸与氢氧化钾发生中和反应,反应的离子方程式为:H++OH-=H2O,故答案为:H++OH-=H2O;
(2)CH3COOH为弱酸,在离子方程式中应写成化学式,其反应的离子方程式为:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO-,
故答案为:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO-;
(3)碳酸钙与盐酸反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(4)澄清石灰水中的氢氧化钙需要拆开,二者反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:Mg2++2OH-=Mg(OH)2↓.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①发生了氧化还原反应 | |
| B. | ①变灰暗是因为生成了过氧化钠 | |
| C. | ③是碳酸钠吸收空气中的水蒸气形成了溶液 | |
| D. | ④⑤只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O含有的质子数为10NA | |
| B. | 1molNa2O2与足量水反应转移的电子数为NA,生成的气体的标况下的体积为22.4L | |
| C. | 1L0.1mol/LHF溶液中含有共价键数目为0.1NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO3可以一步实验 | |
| B. | S是淡黄色固体,易溶于水 | |
| C. | Fe+S→FeS,Fe+Cl2→FeCl3,说明氧化性:Cl2>S | |
| D. | 试管壁上残留的S可以用酒精清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
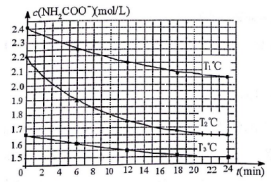 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | CO2通入NaClO 溶液中能生成HClO |
| B | 根据溶液的pH与溶液碱性的关系 | pH=6.8的溶液一定显酸性 |
| C | 组成和结构相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 同主族元素从上至下非金属性减弱 | HF、HCl、HBr、HI的酸性依次减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯和乙酸均能发生加成反应 | |
| B. | 某芳香烃的分子式为C10H14,它可使酸性 KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种 | |
| C. | 1 mol的有机物(结构如图)最多能与含5mol NaOH的水溶液完全反应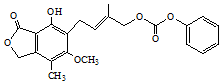 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g H2 所含的原子个数 | |
| B. | 4g 氦气所含的原子个数 | |
| C. | 23g 金属 Na 全部转变为金属离子时失去的电子个数 | |
| D. | 16g O2 所含的分子个数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com