
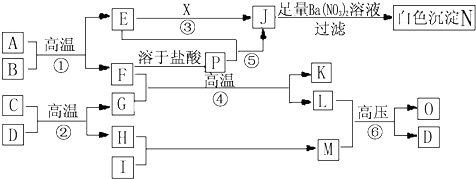
| A、③④ | B、①③④ |
| C、②③④ | D、③④⑤ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
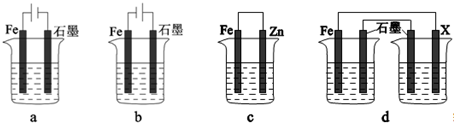
| A、金属钠、镁、铝化学性质活泼,均须密封保存 |
| B、酸式滴定管注入Na2CO3溶液之前应检查是否漏液 |
| C、可用玻璃棒蘸少量待测物质的浓溶液做焰色反应 |
| D、可用盐酸清洗长期存放三氯化铁溶液的试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中各离子浓度为:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | ||||||
B、②升高温度,
| ||||||
| C、③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 | ||||||
| D、③和④等体积混合后溶液的pH<7,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇和乙酸都能与金属钠反应,也都能发生酯化反应 |
| B、乙烯和苯都能使酸性KMnO4褪色,也都能发生加成反应 |
| C、乙酸和油脂都能与氢氧化钠溶液反应,也都能发生氧化反应 |
| D、淀粉和蛋白质都是天然高分子化合物,也都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
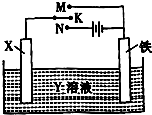 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:丙>丁>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均只有一种 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com