
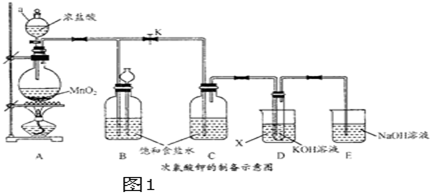

分析 I.装置A中产生氯气,通过控制开关K,反应完毕用装置B收集氯气,防止污染空气,也可以检验装置气密性,可以控制氯气流速,装置C吸收氯气中的HCl,D中发生氯气与氢氧化钾溶液反应生成KClO,应用水进行冷却,E吸收氯气,防止污染空气;
(1)由仪器结构可知,仪器a为分液漏斗;物质X其冷凝作用,可以为冷水;
(2)开始关闭K,可以检验装置气密性;
(3)由题意可知,KClO、KOH、Fe(NO3)3混合水浴加热反应生成K2FeO4,则Cl元素发生还原反应生成KCl,同时生成水;
Ⅱ.(1)阴极发生还原反应,氢离子放电生成氢气;
(2)开始阳极有紫红色物质生成,有K2FeO4生成,一段时间后阳极变细,紫红色消失,出现红褐色沉淀,说明生成氢氧化铁,甲小组中KSCN检验铁离子,可能亚铁离子将K2FeO4还原;
采用控制变量法进行实验,验证随着c(H+)增加K2FeO4发生自身氧化还原反应,应控制K2FeO4的浓度相等,分别加入等体积不同浓度的硫酸、KOH溶液,加入酸可能会有氧气生成,溶液颜色会褪去,且浓度不同反应速率不同,褪色时间不同.
解答 解:I.装置A中产生氯气,通过控制开关K,反应完毕用装置B收集氯气,防止污染空气,也可以检验装置气密性,可以控制氯气流速,装置C吸收氯气中的HCl,D中发生氯气与氢氧化钾溶液反应生成KClO,应用水进行冷却,E吸收氯气,防止污染空气;
(1)由仪器结构可知,仪器a为分液漏斗;物质X其冷凝作用,可以为冷水,
故答案为:分液漏斗;冷水;
(2)开始关闭K,可以检验装置气密性,
故答案为:关闭K,可以检验装置气密性;
(3)由题意可知,KClO、KOH、Fe(NO3)3混合水浴加热反应生成K2FeO4,则Cl元素发生还原反应生成KCl,同时生成水,反应离子方程式为:3ClO-+2Fe3++10 OH-=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+2Fe3++10 OH-=2FeO42-+3Cl-+5H2O;
Ⅱ.(1)阴极发生还原反应,氢离子放电生成氢气,阴极电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)开始阳极有紫红色物质生成,有K2FeO4生成,一段时间后阳极变细,紫红色消失,出现红褐色沉淀,说明生成氢氧化铁,甲小组中FeSO4溶液与K2FeO4溶液混合,用KSCN检验铁离子,提出的假设可能是:阳极产生的Fe2+离子将K2FeO4还原;
采用控制变量法进行实验,验证随着c(H+)增加K2FeO4发生自身氧化还原反应,应控制K2FeO4的浓度相等,具体实验步骤为:分别取试管加入等体积的1mo1/L K2FeO4溶液,分别滴加等体积的1mol/LH2SO4溶液、4mol/L H2SO4溶液、1 mo1/L KOH溶液、8mol/L KOH溶液,需要记录的现象与数据为:加入硫酸是否产生气泡,溶液紫色是否褪去,紫红色褪去时间等,
故答案为:阳极产生的Fe2+离子将K2FeO4还原;
分别取试管加入等体积的1mo1/L K2FeO4溶液,分别滴加等体积的1mol/LH2SO4溶液、4mol/L H2SO4溶液、1 mo1/L KOH溶液、8mol/L KOH溶液;
加入硫酸是否产生气泡,溶液紫色是否褪去,紫红色褪去时间.
点评 本题考查物质制备实验、实验方案的分析评价与设计、对装置的分析评价等,是对学生综合能力的考查,难度较大.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:填空题
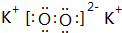 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等浓度的Ca(HCO3)2 溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O | |
| B. | NH4HCO3 溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量SO2通入苯酚钠溶液转:C6H5O-+SO2+H2O═C6H5OH+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2 +2H2O═Al(OH)3 ↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
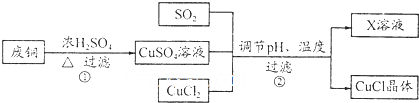
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
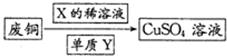
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 药品名称 | 熔点/℃ | 沸点/℃ | 密度g/cm3 | 溶解性 |
| 正丁醇 (CH3CH2CH2OH) | -89.5 | 117.7 | 0.8098 | 微溶于水,溶于浓硫酸 |
| l-溴丁烷 (CH3CH2CH2CH2Br) | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键、极性键、非极性键 | B. | 氢键、氢键、极性键 | ||
| C. | 氢键、氢键、非极性键 | D. | 氢键、非极性键、极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | =393.28 kJ | B. | =196.64 kJ | C. | <196.64 kJ | D. | >196.64 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com