
| A、对0.1mol/L的四种溶液H2SO4、NaOH、Na2CO3、NaCl分别加热至900C,溶液的PH都保持不变 |
| B、由0.01mol/L一元酸HA溶液的pH=4,可推知NaA溶液存在A-+H2O?HA+OH- |
| C、常温下由0.1mol/L一元碱BOH溶液的pH=12,可推知BOH溶液存在BOH=B++OH- |
| D、在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 |
| Kw |
| c(OH-) |
| Kw |
| c(OH-) |


科目:高中化学 来源: 题型:
| A、铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| B、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| C、向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,目的是除去MgCl2溶液中少量的FeCl3 |
| D、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应N2(g)+3H2(g)?2NH3(g);△H<0在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
反应N2(g)+3H2(g)?2NH3(g);△H<0在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )| A、第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3):T2<T3 |
| B、Ⅰ、Ⅱ、Ⅲ三个阶段H2的转化率:αⅠ(H2)>αⅡ(H2)>αⅢ(H2) |
| C、Ⅰ、Ⅱ、Ⅲ三个阶段平均反应速率:vⅠ(N2)>vⅡ(N2)>vⅢ(N2) |
| D、第Ⅱ阶段采取的措施是将NH3从第Ⅰ阶段平衡混合物中分离出去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该酒是在53℃条件下酿制的 |
| B、该酒的着火点为53℃ |
| C、100 mL该酒中含有53 mL酒精 |
| D、100g该酒中含有53g酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
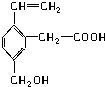 (双项)某有机物的结构如图,对这种有机物的说法正确的是( )
(双项)某有机物的结构如图,对这种有机物的说法正确的是( )| A、能使酸性KMnO4溶液褪色 |
| B、能发生酯化反应 |
| C、不能跟NaOH溶液反应 |
| D、能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com