
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D、用浓硫酸吸收二氧化硫中混有少量SO3气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2OCH3 |
| B、CH3COOH |
| C、CH3CH2CH2OH |
| D、CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
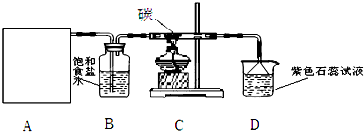
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+一定存在 |
| B、100 mL溶液中含0.02 mol CO32- |
| C、Cl-一定存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀盐酸的反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、灼热的碳与二氧化碳的反应 |
| D、酒精在空气中的燃烧反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com