
��1���ϳɰ���ӦN2��g��+3H2��g�� 2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ��1mol N2��3mol H2��ƽ���NH3���������Ϊa�����ں��¡�������������ƽ����ϵ��ͨ��lmol N2��3mol H2��ƽ���NH3���������Ϊb����a b������ڡ��������ڡ�����С�ڡ�����
2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ��1mol N2��3mol H2��ƽ���NH3���������Ϊa�����ں��¡�������������ƽ����ϵ��ͨ��lmol N2��3mol H2��ƽ���NH3���������Ϊb����a b������ڡ��������ڡ�����С�ڡ�����
��2����һ���п̶ȵ�������һ������ĸ�Ĥ�ֳ����������֣�����ͼ��ʾ��
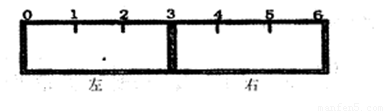
���ø�ĤΪ�����ӽ���Ĥ��ֻ��������������ͨ�������ҽ���Ĥ�̶���3������߳�����������KSCN��Һ��FeCl2��Һ���ұ߳�������KMnO4��Һ��һ��ʱ���ɹ۲쵽�������� ���� ����������ѡ����ѡ��
A����������B����Һ��Ϊ��ɫC����Һ��ɫ��dz D���к��ɫ��������
��д���ұ߲�������������ӷ���ʽ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 =PtF6-��g����H2=-771.1kJ?mol-1
=PtF6-��g����H2=-771.1kJ?mol-1| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���û�ѧ��Ӧԭ���о��������⣺
���û�ѧ��Ӧԭ���о��������⣺ 2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ��
2NH3��g�������ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| t/��K�� | 298 | 398 | 498 | �� |
| K/��mol?L-1��-2 | 4.1��106 | K1 | K2 | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com