
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:
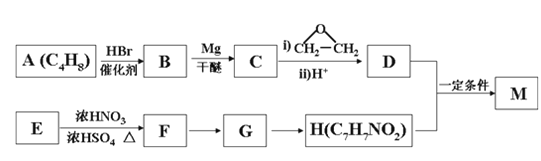
已知以下信息:①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
②RX![]() RMgX
RMgX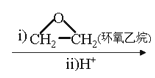 RCH2CH2OH。
RCH2CH2OH。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式_______________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_____种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________(写结构简式)。
【答案】![]() 2—甲基丙烯
2—甲基丙烯 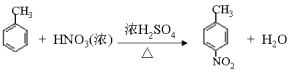 还原反应 n
还原反应 n ![]()
![]()
![]() +(n—1)H2O
+(n—1)H2O 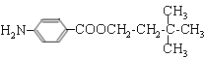 15
15 ![]()
【解析】
由有机物的转化关系可知,A与溴化氢发生加成反应生成B,核磁共振氢谱显示B只有一种化学环境的氢,则B的结构简式为BrC (CH3)3,则A的结构简式为CH2=C(CH3)2;根据已知②可知C与环氧乙烷反应生成D,则D的结构简式为(CH3)3CCH2CH2OH;E为芳香烃,其相对分子质量为92,则E是甲苯;甲苯发生硝化反应生成F,由于H苯环上有两种化学环境的氢,这说明硝基在甲基的对位,即F的结构简式为![]() ;由于氨基易被氧化,所以F生成G是甲基的氧化反应,引入羧基,即G的结构简式为
;由于氨基易被氧化,所以F生成G是甲基的氧化反应,引入羧基,即G的结构简式为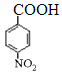 ;G中的硝基被还原转化为氨基,则H的结构简式为
;G中的硝基被还原转化为氨基,则H的结构简式为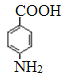 ;H和D发生酯化反应生成M,则M的结构简式为
;H和D发生酯化反应生成M,则M的结构简式为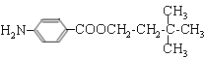 。
。
(1)A的结构简式为![]() ,名称为2-甲基丙烯,故答案为:
,名称为2-甲基丙烯,故答案为:![]() ;2-甲基丙烯;
;2-甲基丙烯;
(2)由E生成F的反应为甲苯发生硝化反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为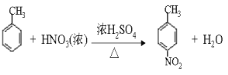 ,故答案为:
,故答案为: ;
;
(3)由G生成H的反应为 发生还原反应生成
发生还原反应生成 ;
; 分子中含有羧基和氨基,在一定条件下可以发生缩聚反应生成
分子中含有羧基和氨基,在一定条件下可以发生缩聚反应生成![]() 和水,反应的化学方程式为 n
和水,反应的化学方程式为 n![]()
![]()
![]() +(n—1)H2O,故答案为:还原反应;n
+(n—1)H2O,故答案为:还原反应;n![]()
![]()
![]() +(n—1)H2O;
+(n—1)H2O;
(4) 和(CH3)3CCH2CH2OH 在浓硫酸做催化剂作用下发生酯化反应生成
和(CH3)3CCH2CH2OH 在浓硫酸做催化剂作用下发生酯化反应生成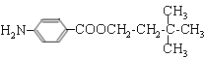 ,则M的结构简式为
,则M的结构简式为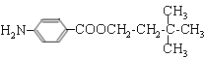 ,故答案为:
,故答案为: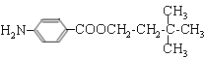 ;
;
(5)D的同分异构体中不能与金属钠反应生成氢气,说明含有醚键,可以是CH3OC5H11,CH3—没有同分异构体,C5H11—有8种,相应醚有8种;可以是C2H5OC4H9,C2H5—没有同分异构体,C4H9—有4种,相应醚有4种;可以是C3H7OC3H7,C3H7—有2种,相应的醚类有3种,共计15种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是![]() ,故答案为:15;
,故答案为:15;![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为________,含有的化学键类型为_________________。
(2)生成物中含有一个10个电子的分子,该分子的空间构型为________,中心原子的杂化方式为________。
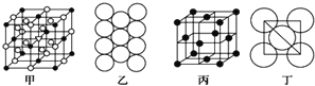
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是________(填微粒符号)。
(4)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。则一个晶胞中Al原子的数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过![]() 容积的试管加热
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤加热坩埚要垫上石棉网
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管竖直伸入试管内滴加液体
⑨稀释浓硫酸时,应沿器壁缓缓地将水加入浓硫酸中
⑩用镊子从煤油中取出金属钠,再用小刀切一小块,然后将剩下的钠放回原瓶
A.①④⑦⑩B.①④⑤⑦⑩C.①④⑤⑦⑧⑩D.④⑤⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____B(选填“>或“<”);第一电离能N>O,原因是__________________________________________。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①![]() 的空间构型为_____________,其中硫原子采用____________杂化。
的空间构型为_____________,其中硫原子采用____________杂化。
②与![]() 互为等电子体的分子的化学式为_________________(任写一种即可)
互为等电子体的分子的化学式为_________________(任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。
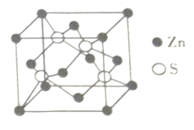
①与Zn原子距离最近的Zn原子有___________个。
②该化合物的化学式为_________________________________。
③已知该晶体的晶胞参数为a×10-12m,阿伏加德罗常数为NA。则该晶体的密度为__________________g/cm3(列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最早的麻醉药是从南美洲生长的古柯植物提取的可卡因,目前人们已实验并合成了数百种局部麻醉剂,多为羧酸酯类。F是一种局部麻醉剂,其合成路线:
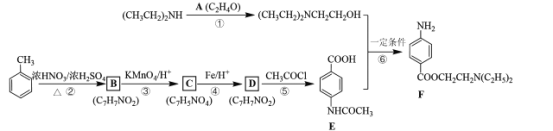
回答下列问题:
(1)已知A的核磁共振氢谱只有一个吸收峰,写出A的结构简式____。
(2)B的化学名称为________。
(3)D中的官能团名称为____,④和⑤的反应类型分别为________、____。
(4)写出⑥的化学方程式____。
(5)C的同分异构体有多种,其中-NO2直接连在苯环上且能发生银镜反应的有_____种,写出其中苯环上一氯代物有两种的同分异构体的结构简式____________。
(6)参照上述流程,设计以对硝基苯酚钠、乙醇和乙酰氯(CH3COCl)为原料合成解热镇痛药非那西丁(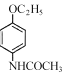 )的合成路线(无机试剂任选)。已知:
)的合成路线(无机试剂任选)。已知: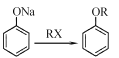 __________
__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)下列反应中,属于放热反应的_________,属于吸热反应的是__________填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的炭 ⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
(2)断开1 mol H—H键、1 mol N—H键、1 mol N![]() N分别需要吸收能量为436 kJ、391 k、946kJ,则1 mol H2与足量N2反应生成NH3需__________(填“吸收”或“放出”)能量______kJ。(认为反应进行到底)。(小数点后保留两位数字)
N分别需要吸收能量为436 kJ、391 k、946kJ,则1 mol H2与足量N2反应生成NH3需__________(填“吸收”或“放出”)能量______kJ。(认为反应进行到底)。(小数点后保留两位数字)
(3)X、Y两种前20号主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,且X、Y两元素不在相邻的两个周期,则XY2的电子式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,2.24L苯含C-H键的数H为0.6NA
B. 5.6gFe与过量稀硝酸反应,转移的电子数为0.3NA
C. K35ClO3与浓H37Cl反应制得7.1g氯气,则生成的Cl2分子数为0.1NA
D. 6.4gCu与40 mL10mol/L浓硝酸充分反应,生成的NO2分子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com