
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:下列叙述正确的是
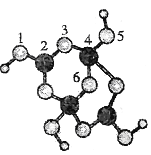
A.Xm-的化学式为B4O8H42-
B.硼原子轨道的杂化类型有sp2、 sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、配位键两种化学键
【答案】B
【解析】
A.观察模型,1,3,5,6代表氧原子,2,4代表B原子,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,则Xm-的化学式为:(H4B4O9)2-,故A错误;
B.根据图知,B原子价层电子对个数是3的采用sp2杂化、是4的采用sp3杂化,故B正确;
C.含有空轨道的原子和含有孤电子对的原子之间易形成配位键,B原子含有空轨道、O原子含有孤电子对,4,5(或5,4)原子之间存在配位键,故C错误;
D.硼砂晶体中有离子键、配位键和共价键三种化学键,故D错误;
故选B。
【点晴】
本题考物质结构和性质,涉及配合物成键情况、原子杂化、等知识点,为高频考点,知道配位键的构成条件,会判断原子杂化方式是解答关键。根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() (a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化;3号氧原子形成2个单键,钠离子与Xm-形成离子键。
(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,1,3,5,6代表氧原子,2,4代表B原子,2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化;3号氧原子形成2个单键,钠离子与Xm-形成离子键。


科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
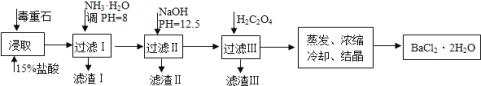
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
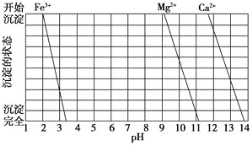
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.1g氢气在氧气中完全燃烧生成气态水,放出的热量为120.9kJ,氢气的燃烧热大于241.8kJmol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出的热量为19.3kJ,其热化学方程式为N2(g)+3H2(g)=2NH3(g)ΔH=﹣38.6kJ·mol-1
C.常温下,若反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
D.已知中和热为57.3kJ·mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向1L0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是( )
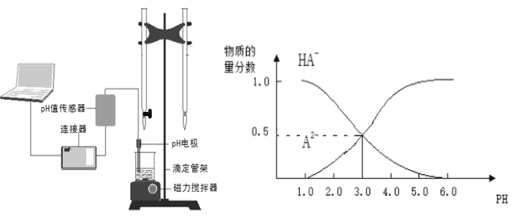
A.pH=4.0时,图中n(HA-)约为0.0091mol
B.该实验应将左边的酸式滴定管换成右边碱式滴定管并加酚酞作指示剂
C.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧和硫的化合物在化工生产上应用非常广泛.试回答下列问题:
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。
己知:6Ag(s)+O3(g)═3Ag2O(s);△H=﹣235kJ/mol;
2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
则反应2O3(g)=3O2(g)的△H=___。
(2)SO2Cl2常用于制造医药品、染料、表面活性剂等.已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
(3)对(2)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图所示。
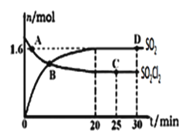
①0~20min反应的平均速率v(SO2Cl2)=___。△H___0(填“<”“>”或“=”)其原因是:___。
②下列叙述正确的是___。
A.A点v正(SO2Cl2)>v逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液,分别滴定
溶液,分别滴定![]() 浓度均为
浓度均为![]() 溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是
溶液和HCN溶液,所得滴定曲线如图。下列说法正确的是![]()

A.点![]() 和点
和点![]() 所示溶液中:
所示溶液中:![]()
B.醋酸的滴定终点是![]()
C.滴定![]() 过程中不可能出现:
过程中不可能出现:![]()
D.滴定HCN过程中可以用酚酞试液指示终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸即阿司匹林是最常用的解热镇痛药,其结构如图所示。关于它的描述中不正确的是( )
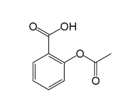
A.分子式为C9H8O4
B.其在酸性条件下水解产物遇氯化铁溶液可以呈现紫色
C.1mol 乙酰水杨酸最多可以与3molH2 反应
D.1mol 乙酰水杨酸最多可以与2molNaOH 反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com