
| A、与酸反应产生的氢气多 |
| B、与碱反应产生的氢气多 |
| C、一样多 |
| D、不知道铝粉的质量,无法比较 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两途径最终达到平衡时,体系内混合气的平均相对分子质量不同 | ||
| B、两途径最终达到平衡时,体系内混合气的百分组成相同 | ||
| C、达平衡时,途径Ⅰ的反应速率v(A)小于途径Ⅱ的反应速率v(A) | ||
D、达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
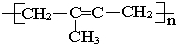
| A、丙烯 |
| B、2-甲基-1,3-丁二烯 |
| C、乙烯和丙烯 |
| D、2-甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、铜锌原电池工作时,电流沿外电路从铜电极流向锌电极 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、为加快锌粒与盐酸反应的速率,可以向溶液中加入几滴氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A、甲组和乙组的实验中,盐酸均是过量的 |
| B、盐酸的物质的量浓度为0.8mol/L |
| C、合金中镁铝的物质的量之比为1:1 |
| D、丙组中铝的物质的量为0.018mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4mol SO2+2mol O2 |
| B、1mol SO2+1mol O2 |
| C、1mol SO2+1mol O2+1mol SO3 |
| D、1mol SO2+0.5mol O2+1mol SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com