
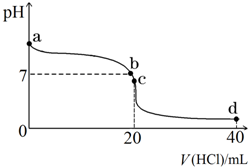
 室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.分析 一水合氨是弱电解质,在水溶液里存在电离平衡,电离方程式为NH3•H2O?NH4++OH-,b点溶液呈中性,则c(H+)=c(OH-),氯化铵是强酸弱碱盐,其水溶液呈酸性,要使其水溶液呈中性,则氨水应该稍微过量,c点溶液呈酸性,结合电荷生成判断.
解答 解:(1)一水合氨是弱电解质,在水溶液里只有部分电离,电离出氢氧根离子和铵根离子,一水合氨的电离方程式为:NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(2)b点溶液呈中性,则c(H+)=c(OH-),氯化铵是强酸弱碱盐,其水溶液呈酸性,要使其水溶液呈中性,则氨水应该稍微过量,则溶质为NH4Cl、NH3•H2O,
故答案为:NH4Cl、NH3•H2O;
(3)c点溶液呈酸性,c (H+)>c (OH-),由溶液的电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+)可知c (Cl-)>c (NH4+),溶液呈酸性为铵根离子水解导致,则浓度大小顺序为c (Cl-)>c (NH4+)>c (H+)>c (OH-),
则故答案为:c (Cl-)>c (NH4+)>c (H+)>c (OH-).
点评 本题考查了酸碱混合溶液定性判断,明确溶液中的溶质及其性质是解本题关键,再结合溶液的酸碱性及物料守恒和电荷守恒来分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨是非电解质,但液态氯化氢是强电解质 | |
| B. | 体积不同但pH相同的醋酸和盐酸,用蒸馏水分别稀释至原体积的m倍和n倍后两溶液的pH值仍相同,m和n的相对大小无法确定 | |
| C. | CuCl2+2H2O═Cu(OH)2+2HCl,加入少量硝酸银固体后可以增大CuCl2水解程度 | |
| D. | I-、K+、Na+、NO3-、Cl-一定可以在甲基橙呈黄色的溶液中大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)| 酸 | 电离平衡常数(Ka) | 酸 | 电离平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com