��������1���ٸ���v=
���㣻
�����ȼ����ƽ��ʱ�����ʵ�Ũ�ȣ�����K=
���㣬�ڶ����¶ȱȵ�һ��ߣ���Ӧ�����ʵ����ȵ�һ����룬����ƽ��ʱCO
2�����ʵ����ȵ�һ���һ���٣������÷�ӦΪ���ȷ�Ӧ��
�۷�Ӧǰ������������䣬ʵ��2���Ƶ�ƽ��״̬���������ʵ����������ֱ���ȣ���Ϊ��Чƽ�⣬����CO��g����H
2O��g�������ʵ���Ϊ1��2�����ڵ���ƽ��ʱ��t��3min�����ʵ���Ӧ��ʵ��2���ʹ�ô�����
��2��������������Ի�ѧƽ���Ӱ���жϣ�
��3������Ũ���̺�ƽ�ⳣ���ıȽϿ����жϳ�ƽ���ƶ�������������ʽ����ƽ�ⳣ�����Լ����ƽ��ʱ�����ʵ�Ũ�ȣ�������ö�����̼�����ʵ�����
���
�⣺��1���ٸ��ݷ���ʽ��֪v��CO��=v��CO
2������v��CO
2��=v��CO��=
=0.16mol/��L?min�����ʴ�Ϊ��0.16mol/��L?min����
��H
2O��g��+CO��g��

CO
2��g��+H
2��g��
��ʼ 1mol/L 2mol/L 0 0
ת�� 0.8mol/L 0.8mol/l 0.8mol/l 0.8mol/l
ƽ�� 0.2mol/L 1.2mol/L 0.8mol/l 0.8mol/l
����K=
����ɵø÷�Ӧ��650��ʱƽ�ⳣ����ֵΪK=
=
=2.67��
ʵ��1��CO��ת����Ϊ
��100%=40%��ʵ��2��CO��ת����Ϊ
��100%=20%����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ�������Ӧ���ȣ��淴ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ��2.67������
�۷�Ӧǰ������������䣬ʵ��2���Ƶ�ƽ��״̬���������ʵ����������ֱ���ȣ���Ϊ��Чƽ�⣬����CO��g����H
2O��g�������ʵ���Ϊ1��2����a��b=1��2��b=2a�����ڵ���ƽ��ʱ��t��3min���������ʽ�ʵ��2�죬��a��0.5����ʹ�ô�������
�ʴ�Ϊ��b=2a��a��0.5����ʹ�ô�������
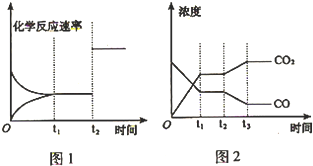
��2����ͼ1�У�t
2���淴Ӧ����ͬʱͬ�ȳ̶��������ڷ�Ӧǰ���������ʵ�����ͬ������ѹǿ��ѧƽ�ⲻ�����ƶ��������淴Ӧ���ʱ仯�̶���ͬ��������������ĸı�Ϊ�����������С����������ʴ�Ϊ�������������С���������
��ͼ2��ʱ��t
2CO
2Ũ������COŨ�ȼ�С������ѧƽ�������ƶ�����������t
2ʱ������Ũ�Ȳ��䣬��ѹǿ���䣬����˵��������Ϊѹǿ�仯������ƽ����ƶ���ֻ��Ϊ�¶ȵ�Ӱ�죬��ΪH
2O��g����H
2Ũ�ȵ�Ӱ�죬��������ΪͨH
2O��g�����»��СH
2Ũ�ȣ��ʴ�Ϊ��ͨH
2O��g�����»��СH
2Ũ�ȣ�
��3���跴Ӧʱת����CO
2xmol/L
������������������H
2O��g��+CO��g��

CO
2��g��+H
2��g��
��ʼ ��mol/L���� 3 1 1 5
ת�� ��mol/L�� x x x x
ƽ�� ��mol/L�� 3+x 1+x 1-x 5-x
Qc=
=
=
��K������ƽ�����淴Ӧ������У�
����K=
=1���ɽ��x=0.2������ƽ��ʱCO
2�����ʵ���Ϊ��1mol/L-0.2mol/L����1L=0.8mol���ʴ�Ϊ���淴Ӧ��0.8mol��

 CO2��g��+H2��g��
CO2��g��+H2��g�� CO2��g��+H2��g��
CO2��g��+H2��g��

 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
 ��
�� ��B��
��B�� ��
�� ��C��
��C�� ��
�� ��D��
��D�� ��
�� ��E��
��E�� ��
�� ��F����ϩ�ͻ���ϩ��
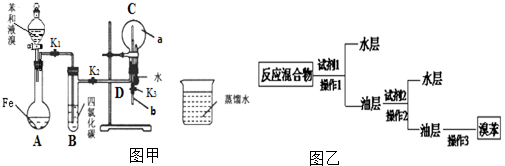
��F����ϩ�ͻ���ϩ�� ʵ����������ͼװ�ý����к��ȵIJⶨ����ش��������⣺
ʵ����������ͼװ�ý����к��ȵIJⶨ����ش��������⣺