
 SO2(g) ΔH=-297.16 kJ·mol-1,
SO2(g) ΔH=-297.16 kJ·mol-1, 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。| A.1 mol SO2(g)的能量总和大于1 mol S(s)和1 mol O2(g)的能量总和 |
| B.将2 mol SO2(g)与1 mol O2(g)在一定条件下充分反应,放出196.6 kJ的热量 |
| C.S(g)+O2(g)=SO2(g) ΔH=-Q,Q值小于297.16 kJ |
| D.当1 mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46 kJ的热量 |
科目:高中化学 来源:不详 题型:填空题
 ,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
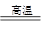 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: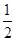 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1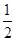 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1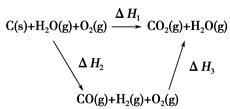
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com