
科目:高中化学 来源: 题型:填空题
| 次序 | 稀盐酸(mL) | 余固体(g) |
| 1 | 先加入5.0mL | 1.32 |
| 2 | 再加入5.0mL | 0.64 |
| 3 | 再加入5.0mL | 0.20 |
| 4 | 再加入5.0mL | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③ | C. | ②③⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强 | |
| B. | 它们的原子半径依次增大 | |
| C. | 它们的单质在常温.常压下的密度依次减小 | |
| D. | 它们的最高价氧化物的水化物都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
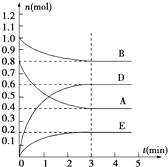 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)随温度的升高而降低 | |
| B. | 35℃时,c(H+)>c(OH-) | |
| C. | 溶液pH:pH(35℃)>pH(25℃) | |
| D. | 35℃时已电离的水的浓度约为1.45×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验装置 | 现象 |
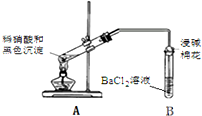 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com