
| A. | 用酸性KMnO4溶液鉴别乙烯和乙醇 | |
| B. | 将乙烷与溴水混合光照制溴乙烷 | |
| C. | 苯和硝基苯的混合物采用分液的方法分离 | |
| D. | 可用CCl4萃取碘水中的碘 |
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
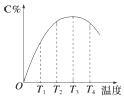 (1)估计下列各变化过程是熵增还是熵减.
(1)估计下列各变化过程是熵增还是熵减.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小:W>Z>Y | |
| B. | 简单气态氢化物的热稳定性:W>X | |
| C. | Y、Z、W最高价氧化物对应水化物能够两两发生反应 | |
| D. | 简单离子的还原性:X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
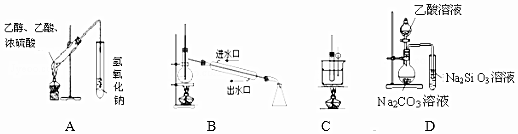
| A. | 装置用于制备乙酸乙酯 | |
| B. | 装置用于石油的分馏 | |
| C. | 装置用于实验室制硝基苯 | |
| D. | 装置可装置证明酸性:乙酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下电离常数为Ka的酸HA溶液中c(H+)$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合:2c(H+)-2 c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com