
下列物质分类正确的是
①混合物:铝热剂、碱石灰、水玻璃、漂白粉
②化合物:氯化钙、烧碱、冰水混合物、胆矾
③酸性氧化物:Mn2O7、N2O3、SiO2、NO2
④碱性氧化物:Na2O2、CuO、Al2O3、MgO
⑤同素异形体:C60、C70、金刚石、石墨
⑥强电解质:AlCl3 、 BaSO4 、MgO、 Ba(OH)2
A.①②⑤⑥ B.②③④⑥ C.①②④⑤ D.①②④⑥
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
2008年5月17日新疆电视台(午间新闻)报道:我国新增阿勒泰大气背景监测点。这标志着气候条件独特、空气质量优良的新疆阿勒泰市已成为我国第8个国家大气背景监测点。监测点安装的监测设备可监测日常二氧化硫、二氧化氮、一氧化氮等污染物。NO分子因污染空气而臭名昭著,近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题:
(1)NO对环境的危害在于________(填编号)。
A.破坏臭氧层
B.高温下能使一些金属氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+的酶的活化中心,亚硝酸根离子(NO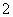 )可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________________________。
)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:_________________________________________。
(3)“绿色奥运”是2008年北京奥运会的主题之一,为迎接奥运,减少空气污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳和一氧化氮转化为参与大气循环的无毒混合气体,该气体是( )
A.二氧化碳和氮气 B.二氧化碳和二氧化氮
C.二氧化碳和氧气 D.二氧化碳和氢气
(4)氟利昂(如CCl2F2)可在光的作用下分解,产生氯原子,氯原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应如下:
O3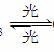 O2+O Cl+O3ClO+O2 ClO+OCl+O2 总反应:2O3===3O2
O2+O Cl+O3ClO+O2 ClO+OCl+O2 总反应:2O3===3O2
在上述臭氧变成氧气的过程中,Cl是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将pH=3的H2SO4和pH=12的NaOH溶液混合,当混合溶液的pH=10时,强酸和强碱的体积之比为( )
A.1∶9 B.9∶1 C.10∶1 D.1∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.用CuCl2溶液做导电性实验时灯泡发光:CuCl2 Cu2+ +2Cl—
B.2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O是氧化还原反应
C.HClO中氯元素化合价比HClO4中氯元素化合价低,
所以HClO4的氧化性强
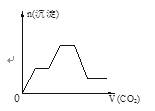
D.将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,
生成沉淀与通入CO2的量的关系可表示为右图
查看答案和解析>>
科目:高中化学 来源: 题型:
运用有关概念判断下列叙述正确的是( )
A.1molH2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.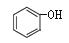 和
和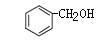 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见气体甲。X、Y、Z 3种元素形成化合物乙。下列说法不正确的是 ( )
A.原子半径:W>Y>Z>M>X B.化合物乙中一定只有共价键
C.由W元素形成的单质以及W与Z两元素形成的化合物都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示水槽中试管内有一枚铁钉,放置数天后观察:
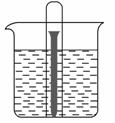 (1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若试管内液面上升,则原溶液呈________性,发生________腐蚀,电极反
应式为:负极:____________________,正极:____________________。
(3)若试管内液面下降,则原溶液呈________性,发生________腐蚀。电极反应式为,负极:____________________,正极:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com