
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
【答案】D
【解析】A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法,A错误;B. 氯碱工业是电解饱和食盐水,溶液中阳极上氢离子和阴极上氯离子放电,在阴极产生氢氧化钠,为防止氯气与氢氧化钠反应采用阳离子交换膜,使钠离子转移到阴极,所以提高产品纯度,B错误;C.MgCl2溶液加热,镁离子水解生成氢氧化镁和氯化氢,氯化氢易挥发,使水解可以完全,因此由MgCl2·6H2O得到无水MgCl2的关键是抑制MgCl2的水解,C错误;D.海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,溴得电子化合价降低,所以溴元素被还原,因此溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原,D正确;答案选D.


科目:高中化学 来源: 题型:
【题目】室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH)。下列判断正确的是( )

A.HA的浓度为1×10-4molL-1 B.实验时可选甲基橙作指示剂
C.pH=7时,溶液中c(Na+)>c(A-) D.V=10mL,酸碱恰好中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。
I.进行如下实验:

请回答:
(1)经Ⅰ得到蓝色溶液,该过程中一定发生的化学反应是(用离子方程式表示)______。
(2)反应II的化学方程式是______________ ,X中一定含有的物质是________。
II.为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。

(3)上述过滤操作如果缺少洗涤步骤,会使得测定的固体质量均_______(填偏大、偏小或无影响)
(4)步骤Ⅳ所得蓝色溶液中阳离子为___________________(5)原混合物中SiO2的质量是___________X中一定不含有的物质是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
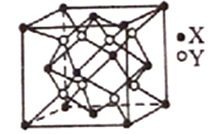
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。
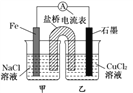
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式:_____________________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是,“溶液中的十3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:________________________________。
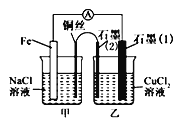
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是_______________,电极反应为________________;乙装置中石墨(1)为_______(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)是无色透明有水果香气的液体,俗称安息香酸乙酯,常用做溶剂和香料。下列说法正确的是( )
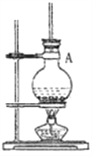
A. 按如图装置制备苯甲酸乙酯,应在烧瓶A中先加入3mL浓H2SO4和4g苯甲酸,然后边振荡烧瓶边慢慢加入10mL乙醇
B. 如图是制备苯甲酸乙酯的简易装置,A中玻璃导管改用球形玲凝管效果更好
C. 制得的苯甲酸乙酯粗产品,可通过水洗、NaOH溶液洗涤、水洗,除去苯甲酸乙酯中的部分杂质
D. 分子式为C9H10O2,含有苯环且能与饱和NaHCO3溶液反应放出气体的有机物共有15种(不含立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com