

���� ��1�����ữʱ�����ķ�ӦΪ��2CrO42-+2H+?Cr2O72-+H2O���ݴ�д��K�ı���ʽ��
�ڸ����غ��й�ϵʽ��2Cr��2CrO42-��Cr2O72-����ʽ�����n��Cr2O72-����n��CrO42-��ʣ������������ữ��������Һ��c��Cr2O72-����
�۸��ݷ�Ӧ 2CrO42-+2H+�T?Cr2O72-+H2O��ƽ�ⳣ��K�T1014�������c��H+��=1.0��10-6mol����PH=6��
��2�����ݳ����ܽ�ƽ��CrO42-+Ba2+?BaCrO4��Ksp��BaCrO4��=C��CrO42-����C��Ba2+��=1.2��10-10���ɵ�C��Ba2+����
��� �⣺��1�����ữʱ�����ķ�ӦΪ��2CrO42-+2H+?Cr2O72-+H2O����K�ı���ʽΪK=$\frac{c��Cr{\;}_{2}O{\;}_{7}{\;}^{2-}��}{c��CrO{{\;}_{4}}^{2-}����c��H{\;}^{+}��}$��
�ʴ�Ϊ��$\frac{c��Cr{\;}_{2}O{\;}_{7}{\;}^{2-}��}{c��CrO{{\;}_{4}}^{2-}����c��H{\;}^{+}��}$��
����1L�ữ��������Һ�к���Ԫ�ص�����Ϊ28.6g��CrO42-�� $\frac{10}{11}$ת��ΪCr2O72-��˵����Ԫ���� $\frac{10}{11}$ת��ΪCr2O72-
�����غ��й�ϵʽ��2Cr��2CrO42-��Cr2O72-
2 1
$\frac{28.6��\frac{10}{11}}{52}$mol n��Cr2O72-��
��n��Cr2O72-��=0.25mol��n��CrO42-��ʣ��=0.05mol��
����ữ��������Һ��c��Cr2O72-��=$\frac{n}{V}$=0.25mol•L-1��
�ʴ�Ϊ��0.25mol•L-1��
����H+�����ʵ���Ũ��Ϊamol/L��
2CrO42-+2H+?Cr2O72-+H2O
ƽ�⣨mol/L�� 0.05 a 0.25
ƽ�ⳣ��K=$\frac{0.25}{0.05{\;}^{2}��a{\;}^{2}}$�T1014��
��a=1.0��10-6mol��PH=6��
�ʴ�Ϊ��6��
��2��CrO42-+Ba2+?BaCrO4
5.0��10-7mol•L-1 C��Ba2+��
Ksp��BaCrO4��=C��CrO42-����C��Ba2+��=5.0��10-7��C��Ba2+��=1.2��10-10��
C��Ba2+��=2.4��10-4mol/L
�ʴ�Ϊ��2.4��10-4��
���� ���⿼�������ʵķ����ᴿ���̣���Ҫ�����˲������̷��������Ӽ��顢������ұ�����ܶȻ������ļ��㡢����ʽ����д�ȣ���Ŀ�Ѷ��еȣ������ڿ���ѧ���������⡢������������ͼ���������


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 5.6LN2����״������11gCO2 | B�� | 10gH2��10gO2 | ||
| C�� | 9gH2O ��0.5molBr2 | D�� | 22.4mlH2 ����״������0.1molN2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
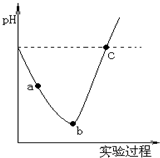 �ڳ����£�ȡһ����������ˮ��Ȼ��Cl2����ͨ��ˮ�������ͣ��������ñ�����ˮ�еμ�0.1mol/L��NaOH��Һ������ʵ���������Һ��pH�仯������ͼ��ʾ������������ȷ���ǣ�������
�ڳ����£�ȡһ����������ˮ��Ȼ��Cl2����ͨ��ˮ�������ͣ��������ñ�����ˮ�еμ�0.1mol/L��NaOH��Һ������ʵ���������Һ��pH�仯������ͼ��ʾ������������ȷ���ǣ�������| A�� | ʵ������п���pH��ֽ�ⶨ��Һ��pH | |
| B�� | ��a����ʾ��Һ������SO2����Һ�����Ժ�Ư���Ծ���ǿ | |
| C�� | ��a�㵽b��Ĺ����У���Һ��c��H+��/c��ClO-����С | |
| D�� | c����ʾ����Һ�У�c��Na+��=c��ClO-��+c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1000mL��106g | B�� | 1000mL��286g | C�� | 950mL��100.7g | D�� | 950mL��271.7g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
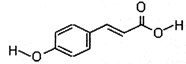
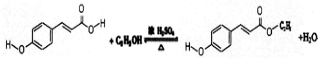 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ�����ǻ�ѧ��Ӧ���п����̶ȵ������� | |
| B�� | ��ѧ��Ӧ����ͨ���õ�λʱ�������ɻ�����ij���ʵ������Ķ�������ʾ | |
| C�� | ��ͬһ����Ӧ�У������÷�Ӧ�������������ʾ��Ӧ���� | |
| D�� | ��ѧ��Ӧ���ʵij��õ�λ��mol/��L•s����mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
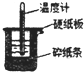 50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺
50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ʒ��ʴʱ��Ҫ�������ⸯʴ | |
| B�� | ʩ������ʯ����Խ����μ�أ����϶�NaCl��Na2CO3���ļ��� | |
| C�� | ��Ƴ�δ�������ķ�ˮ����ֱ���������ũ�� | |
| D�� | ��ˮ�ӵĸ���բ����ֱ����������������Է�բ�Ÿ�ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.4 g��ϩ���ϩ�Ļ�����庬��NA��̼ԭ�� | |
| B�� | ����ͭ��������ʧȥ2NA�����ӣ�����������64 g | |
| C�� | ��1 L 0.1mol/L ��Na2CO3��Һ�У�����������С��0.1NA | |
| D�� | ��1 L 2 mol/L ��FeCl3��Һ���뵽��ˮ�У�����ʹ֮��ȫ��Ӧ������������������������Ϊ2NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com