
����Ŀ��Ϊ��֤���������ʣ�ijС������ͼ��ʾ����ʵ��װ�ý������飬a��b��c��d��e���ǽ��������Һ����ֽ��С��ͬѧ��KMnO4������Ũ���ᷴӦ����ȡ��������������KMnO4����μ�һ��Ũ�������������һ������������森�仯ѧ����ʽΪ��KMnO4+HCl��Ũ����KCl+Cl2��+MnCl2+H2O ��δ��ƽ������ش��������⣺ 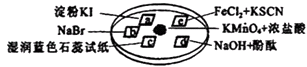
��1��������Ӧ�У�Ԫ�صĻ��ϼ����ߣ���Ԫ�ر���ԭ��
��2����ƽ������Ӧ�� KMnO4+HCl��Ũ���TKCl+Cl2��+MnCl2+H2O
��3��c��ʪ����ɫʯ����ֽ������ �� �����������ԭ���ǣ� ��
��4��e����ֽ��ʵ�������ǣ� �� д��������Fe2+��Ӧ�����ӷ���ʽ�ǣ� ��
��5��������Ӧ���ڱ�״���²���56L����������ת�Ƶ���Ϊ ��
���𰸡�
��1��Cl�� Mn
��2��2��16��2��5��2��8
��3����죻��ɫ����ˮ�������Ժ�Ư����
��4��Ѫ��ɫ��2Fe2++Cl2=2Fe3++2Cl��
��5��5mol
���������⣺��1��MnԪ�صĻ��ϼ۽��ͣ�ClԪ�صĻ��ϼ����ߣ���MnԪ�ر���ԭ�����Դ��ǣ�Cl��Mn����2���ɵ��ӡ�ԭ���غ��֪��ӦΪ2KMnO4+16HCl=2KCl+5Cl2��+2MnCl2+8H2O�����Դ��ǣ�2��16��2��5��2��8����3��������ˮ��Ӧ����HCl��HClO���������ԡ�Ư���ԣ���ʪ����ɫʯ����ֽ���ȱ�����ɫ�������������ԭ������ˮ�������Ժ�Ư���ԣ����Դ��ǣ���죻��ɫ����ˮ�������Ժ�Ư���ԣ���4��e������2Fe2++Cl2=2Fe3++2Cl������������KSCN��ҺΪѪ��ɫ����e����ֽ��ʵ��������Ѫ��ɫ�����Դ��ǣ�Ѫ��ɫ��2Fe2++Cl2=2Fe3++2Cl������5���ڱ�״���²���56L��������n��Cl2��= ![]() =2.5mol��ת�Ƶ���Ϊ2.5mol��2��[0������1��]=5mol�����Դ��ǣ�5mol��
=2.5mol��ת�Ƶ���Ϊ2.5mol��2��[0������1��]=5mol�����Դ��ǣ�5mol��
�����㾫�������������Ļ�ѧ���ʶ���Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�����Ļ�ѧ���ʣ��������Ӧ�����������ɸ�̬���ǽ�����Ӧ����ˮ��Ӧ����Ӧ���뻹ԭ�����ʷ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҳ���MgCl2��AlCl3�Ļ����Һ�������ˮ��Ӧ�Ʊ�MgAl2O4����Ҫ�������£�
��1���Ʊ�MgAl2O4�����У����±���ʱ������Ӧ�Ļ�ѧ����ʽΪ ��
��2���ж������г����Ƿ�ϴ�����õ��Լ��� ��
��3����25���£���Ũ�Ⱦ�Ϊ0.01mol/L��MgCl2��AlCl3�����Һ����μ��백ˮ���������������ѧʽ�������ɸó��������ӷ���ʽ�� ��
����֪25��ʱKsp[Mg��OH��2]=1.8��10��11 �� Ksp[Al��OH��3]=3��10��34��
��4����Mg��Al��ɵ�9.9g�����Ͷ��һ����ϡ�����У�ǡ����ȫ��Ӧ�����ռ�����ԭ����NO����6.72L����״��������Ӧ�����Һ�м���4mol/L��Na0H��Һ300mLʱ�����γɳ���������Ϊg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ����Ҫ�������ʪ�Թؽ��ס���ʪʹ�ȣ���ϳ�·����ͼ��ʾ�� 
�ش��������⣺
��1��A�Ľṹ��ʽΪ��E�к��������ŵ�����Ϊ ��
��2��D+G��H�ķ�Ӧ����Ϊ��C�Ľṹ��ʽΪ ��
��3��д��F������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��4��д����������������E��ͬ���칹��ṹ��ʽ ��
a�������к��б��� b���ܷ���ˮ�ⷴӦ c���˴Ź���������4���
��5����������кϳ�·��ͼ�й���Ϣ��д���Լױ��ͱ���Ϊԭ���Ʊ� ![]() �ĺϳ�·������ͼ�����Լ�����ѡ���� ��
�ĺϳ�·������ͼ�����Լ�����ѡ���� ��
�ϳ�·������ͼʾ�����£�CH3CHO ![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3 ��
CH3COOCH2CH3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ�����ײ������ʷ�Ӧ�����Ȼ��Ƿ��ȵ�ʵ��װ�ã����ô�װ�ÿ��Ժܷ���ز��ij��Ӧ�Ƿ��ȷ�Ӧ�������ȷ�Ӧ�������װ�ûش��������⣺ 
��1������Ƭ����С�Թ��ڣ�Ȼ��ע������ϡ���ᣬ�йط�Ӧ�����ӷ���ʽ�� �� �Թ��й۲쵽�������� ��
��2��U�ε�����Һ��A������������½�������ԭ���� �� ˵���˷�Ӧ��������ȡ����ȡ�����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹʹ������չʾ��ר�Ҿ�տ�ļ��պͶԴ�ͳ�Ļ����Ȱ�����أ�Ҳ������ᵽ��ѧ���������ﱣ���еľ����á�ij����������������Ĺ������¡�
��1�������ʴ����
��Ҫ�ɷֵĻ�ѧʽ | |||
Fe3O4 | Fe2O3��H2O | FeO(OH) | FeOCl |
�����ھ���O2��________�Ȼ��������ױ���ʴ��
��2��������ʴԭ����һ����Ϊ�������������¸�ʴѭ����
��. Feת��ΪFe2+ ��
��. Fe2+����Ȼ�������γ�FeO(OH)������������Ԫ�صĻ��ϼ�Ϊ_______��
��. FeO(OH)��Fe2+��Ӧ�γ����ܵ�Fe3O4�����㣬Fe2+��������_______��
a.������ b.��ԭ�� c.�Ȳ���������Ҳ���ǻ�ԭ��
��. Fe3O4�����㱻����ΪFeO(OH)�����������ʴ��
![]() ������Ӧ����������___________
������Ӧ����������___________
��3���о����֣�Cl-�����ĸ�ʴ���������Ӱ�졣��ѧ�������ȡ���ԭ���γ�Fe3O4�����㣬�������£�
��������û��ʢ��0.5 mol/L Na2SO3��0.5 mol/L NaOH��Һ�������У�����������60��90�档һ��ʱ�䣬ȡ�������NaOH��Һϴ������Cl-��
�� ���ϴ��Һ��Cl-�ķ�����________��
�� ���ȷ�Ӧ��FeOCl + OH-��FeO(OH) + Cl-�����ӷ�Ӧ�ı���������Ũ�ȵļ�С���Ƚ�FeOCl ��FeO(OH)�ܽ�ȵĴ�С��________��
�� Na2SO3��ԭFeO(OH)�γ�Fe3O4�����ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС��ģ�ҵ��������SO2����
��1�������������װ��������װ���ԣ���
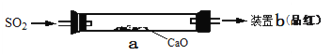
�� CaO�����IJ�����_________��
�� b��Ʒ��ܿ���ɫ��˵������Ч�����á����д�ʩ���������Ч������_____��
��. �ӿ�SO2��������
��. ���Ѽ���һ���CaOƽ��������������
��. ����a������Ч�����ܻ����
�� С����ͨ��CaO������������������������Ҫ������������_______��
��2������ѡ��AgNO3��Һ�ѳ�SO2 ��

����ͨ��SO2���������ɴ�����ɫ����A��
��ɫ����A�ijɷֽ���̽����������裺
����1��������������ԭ��Ӧ��������AgNO3��Һ�к���O2��![]() �Ⱦ��������Ե����ӣ�����A��Ҫ��Ag2SO4���ܣ���
�Ⱦ��������Ե����ӣ�����A��Ҫ��Ag2SO4���ܣ���
����2�������˸��ֽⷴӦ��������SO2��ˮ�����ᣬ����AgNO3��Һ�������ֽⷴӦ��
ʵ��̽����
�� ȡ����A����������ˮ�����á�ȡ�ϲ���Һ�μ�Ba(NO3)2��Һ�������Ա仯��
�� ȡ______����������ˮ�����á�ȡ�ϲ���Һ�μ�Ba(NO3)2��Һ������������
ʵ��֤��������1����������
�� Ϊ��һ��ȷ�ϡ�����2������A�м���ŨHNO3��������������ɫ���塣����Ũ�����Ŀ����________����ȷ�ϣ���Ӧ����Һ����SO![]() ��
��
ʵ��֤��������2��������
�� ��������A�Ļ�ѧ����ʽ��_________��AgNO3��Һ�������õ�����������������۸�ߣ�δ�ܴ��ģʹ�á�
��3��������NaClO�ѳ�SO2����1 L 0.1 mol/L ��NaClO��Һ���������ձ�״���µ�SO2_______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¸��������£����е��뷽��ʽ����д��ȷ���ǣ� ��
A.����״̬�µ�NaHSO4���룺NaHSO4�TNa++H++SO ![]()
B.Fe��OH��3�ĵ��룺Fe��OH��3?Fe3++3OH��
C.H2CO3�ĵ��룺H2CO3?2H++CO ![]()
D.ˮ��Һ�е�NaHSO4���룺NaHSO4�TNa++HSO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�pH=11�İ�ˮ��NaOH��Һ�ֱ��ˮϡ��100������Һ��pH����Һ����仯��������ͼ��ʾ����ͼ�жϴ�����ǣ� �� 
A.a����ֵһ������9
B.��Ϊ��ˮϡ��ʱ��Һ��pH�仯����
C.ϡ�ͺ�ˮ��ˮ�ĵ���̶ȱ�NaOH��Һ��ˮ�ĵ���̶ȴ�
D.��ȫ�к���ͬ���������Һʱ��������ͬŨ�ȵ�ϡ��������V��NaOH����V����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ���뻹ԭ������ʵ�ֵ�ת���� (�� ��)
A. KClO3��Cl2 B. Fe2����Fe3�� C. H2S��SO2 D. HCO��CO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com