
将a g Zn、Mg、Al三种金属的混合物放入适量稀H2SO4中,恰好完全反应,金属和酸都没有剩余;将反应后的溶液蒸干,得不含结晶水的固体b g.试求:
(1)生成氢气的质量;
(2)参加反应的H2SO4的物质的量.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
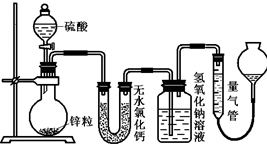 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).| n(H2) |
| n(SO2) |
| 64CV-2m |
| m |
| 64CV-2m |
| m |
| n(H2) |
| n(SO2) |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.0.250 mol B.0.125 mol
C.0.100 mol D.0.080 mol
查看答案和解析>>
科目:高中化学 来源:教材完全解读 苏教版课标版 高中化学 必修1 苏教版课标版 题型:021
|
将5 g某金属加入100 mL 4 mol·L-1的稀H2SO4中,当酸的浓度降至原浓度的一半时(设溶液体积不变),金属还没有全部溶解,该金属可能是( ). | |
A. |
Al |
B. |
Zn |
C. |
Fe |
D. |
Mg |
查看答案和解析>>
科目:高中化学 来源:设计必修一化学人教版 人教版 题型:021
|
将5 g某金属加入到100 mL 2 mol·L-1的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解.该金属可能是 | |
A. |
Al |
B. |
Zn |
C. |
Fe |
D. |
Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com