
将W1 g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次 ,最后取出铜丝用蒸馏水洗涤、干燥、称得其质量为W2 g。实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是
,最后取出铜丝用蒸馏水洗涤、干燥、称得其质量为W2 g。实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是
A.石灰水 W1 <W2 B.CO W1 = W2
C.NaHSO4 W1 >W2 D.乙醇溶液 W1 <W2
科目:高中化学 来源:2016届广西桂林市高三第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③ 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
④ 在标准状况下,22.4LSO3的物质的量为1mol;
⑤ 7.8g过氧化钠中含有的离子数为0.3NA;
⑥ 28g 硅晶体中含有2NA个Si—Si键
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧ 在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA
⑨ 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源:2016届山东省新高三开学初模拟检测化学试卷(解析版) 题型:选择题
镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为
A.26 B.29.1g C.29.5g D.24g
查看答案和解析>>
科目:高中化学 来源:2016届江汉油田海南海政学校高三月考化学试卷(解析版) 题型:选择题
将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3 mol·L-1HCl B.4 mol·L-1HNO3
C.8 mol·L-1NaOH D.18 mol·L-1浓H2SO4
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期起点考试化学试卷(解析版) 题型:填空题
(8 分)氯化铁是常见的水处理剂,无水FeCl3 的熔点为282℃,沸点为315℃。工业上制备无水FeCl3 的一种工艺流程如下:
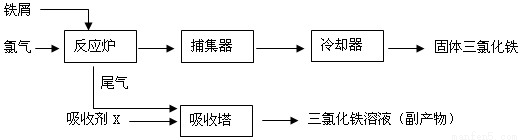
(1)氯化铁能用作水处理剂的原因是_________________(用必要的文字和化学方程式说明)。
(2)吸收塔中吸收剂X 是_______。
(3)温度超过400℃时,捕集器中捕集到的物质的相对分子质量为325,该物质的分子式为________。
(4)从副产物FeCl3 溶液中获得FeCl3·6H2O 的方法是在滴加浓盐酸后,________、________、过滤,洗涤、晾干。
(5)用FeCl3 溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2 和CuCl2。用化学方法回收废液中铜的方法是______________(用反应式表示并简述操作要点)。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三7月月考化学试卷(解析版) 题型:填空题
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2?12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4?FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O AlO2- +4NH4+ +2H2O
AlO2- +4NH4+ +2H2O
D.用双氧水和稀硫酸处理印刷电路板:Cu + H2O2 + 2H+ = Cu2+ + 2H2O
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期开学考试化学试卷(解析版) 题型:填空题
(共15分)利用芳香烃X和烯烃Y可以合成紫外线吸收剂BAD。已知:G不能发生银镜反应,B遇FeCl3溶液显紫色,C到D的过程为引入羧基(—COOH)的反应。其中BAD结构简式为:

BAD的合成路线如下:

试回答下列问题:
(1)写出结构简式:Y ,D 。
(2)上述属于取代反应的有 (填数字序号)。
(3)1molBAD最多可与含 molNaOH的溶液完全反应。
(4)写出方程式
反应④ 。
B+E 。
(5)E有多种同分异构体,判断符合下列要求的同分异构体数目为 种。
①能发生银镜反应
②遇FeCl3溶液显紫色
③核磁共振氢谱图中有四个吸收峰
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三第一次月考化学试卷(解析版) 题型:填空题
(14分)工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
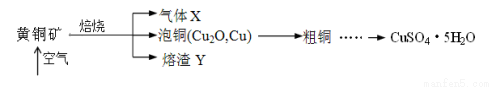
(1)下列装置可用于吸收气体X的是 (填代号)。
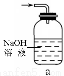
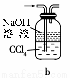

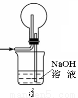
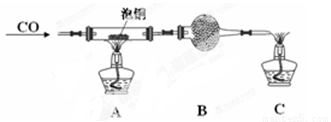
(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为 。
②实验时,依次进行如下操作:组装仪器、 、加装药品、通入气体、 、点燃酒精灯。
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为 。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·L-1滴定剂 EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2-+ 2H+。则CuSO4·5H2O质量分数为________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com