
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO<HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
分析 A、盐的水解原理:越弱越水解,据此确定弱酸的酸性强弱;
B、能水解的盐能促进水的电离,不水解的盐对水的电离无影响;
C、盐的水解原理:越弱越水解,据此根据水解程度确定溶液中离子的浓度;
D、碳酸钠和碳酸氢钠的混合溶液中存在物料守恒.
解答 解:A、盐的水解原理:越弱越水解,根据数据得到NaClO中次氯酸根离子的水解程度小于Na2CO3中碳酸根离子的水解程度,所以酸性:HClO>HCO3-,故A错误;
B、醋酸铵CH3COONH4是能水解的盐能促进水的电离,NaCl是不水解的盐,对水的电离无影响,所以由水电离产生的c(H+):①<②,故B错误;
C、盐的水解原理:越弱越水解,根据数据得到NaClO中次氯酸根离子的水解程度大于NaHCO3中碳酸根离子的水解程度,溶液③④中酸根离子浓度:c(ClO-)<c(HCO3-),故C错误;
D、等体积等浓度碳酸钠和碳酸氢钠的混合溶液中存在物料守恒:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L,故D正确.
故选D.
点评 本题考查了电解质溶液中离子浓度大小、盐的水解原理:越弱越水解、物料守恒的理解应用,注意盐类水解的分析应用,掌握基础是关键,题目难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:推断题
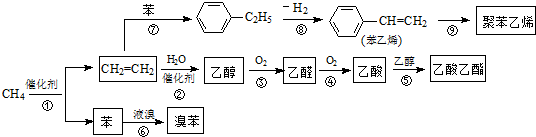
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>M | |
| B. | 1molW溶于足量水中完全反应其转移2mol电子 | |
| C. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定只有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
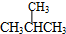 和
和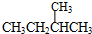 ;
;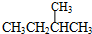 和
和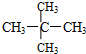 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合,光照一段时间后黄绿色消失 | |
| B. | 乙烯使溴水褪色 | |
| C. | 将苯滴入少量到溴水中,振荡后水层接近无色 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水的pH值一定等于7 | |
| B. | [H+]大于10-7mol/L的溶液一定是酸性溶液 | |
| C. | pH=2的溶液中[H+]是pH=1的溶液的两倍 | |
| D. | [H+]=2×10-7mol/L的溶液可能是中性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热条件下,1 mol Cl2与足量铁粉充分反应,转移的电子数为3NA | |
| B. | 1 L 1 mol/L的Na2CO3溶液中所含Na+ 离子数为NA | |
| C. | 标准状况下,11.2 L H2O中含有的电子数为5NA | |
| D. | 1 mol CO2和O2的混合气体中所含氧原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com