
【题目】铁及其化合物之间的相互转化可用下式表示:Fe2+ ![]() Fe3+
Fe3+ ![]() FeO
FeO ![]() (高铁酸根离子)回答下列有关问题:
(高铁酸根离子)回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是 .
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是 , 每生成l mol Na2FeO4转移mol电子.
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O.
①写出并配平湿法制高铁酸钾的离子反应方程式: .
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 .
【答案】
(1)将适量的硫酸铁溶液置于洁净的试管中,滴加几滴高锰酸钾溶液,充分反应后,溶液紫色退去,则证明其中含有亚铁离子,否则不含
(2)FeSO4、Na2O2;5
(3)2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O;0.15mol
【解析】解:(1)亚铁离子具有还原性,滴入高锰酸钾溶液后,高锰酸钾溶液褪色,说明溶液中存在亚铁离子,所以答案是:将适量的硫酸铁溶液置于洁净的试管中,滴加几滴高锰酸钾溶液,充分反应后,溶液紫色退去,则证明其中含有亚铁离子,否则不含;(2)所含元素化合价升高的反应物是还原剂,反应中化合价升高的元素有Fe、O元素,故还原剂为FeSO4、Na2O2 , 由方程式可知,每生成l mol Na2FeO4同时生成0.5mol氧气,则转移电子为1mol×(6﹣2)=0.5mol×2×[0﹣(﹣1)]=5mol,
所以答案是:FeSO4、Na2O2;5;(3)①湿法制备高铁酸钾(K2FeO4),则FeO42﹣为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO﹣为反应物,Cl﹣为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42﹣的系数为2,ClO﹣的系数为3,Cl﹣的系数为3,根据电荷守恒可知,OH﹣为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O,
所以答案是:2Fe(OH)3+3ClO﹣+4OH﹣=2FeO42﹣+3Cl﹣+5H2O;
②反应中Fe元素化合价变化由+3价升高为+6,故每生成1mol FeO42﹣转移电子,1mol×(6﹣3)=3mol,由于还原产物为Cl﹣ , 若反应过程中转移了0.3mol电子,则还原产物的物质的量为 ![]() =0.15mol,
=0.15mol,
所以答案是:0.15mol.
【考点精析】解答此题的关键在于理解二价Fe离子和三价Fe离子的检验的相关知识,掌握Fe3+遇苯酚溶液呈紫色;可用于检验Fe3+.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】如图所示: 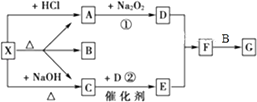
图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)物质X可以是 , C是 , F是 .
(2)反应①的化学方程式是 , 反应②的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿主要含Cu2(OH)2CO3 , 还含少量Fe、Si的化合物.实验室以此铜矿石为原料制备CuSO45H2O及CaCO3 , 部分步骤如图: 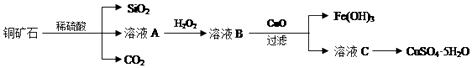
请回答下列问题:
(1)溶液A除含有Cu2+外,还可能含有的金属离子有(填离子符号);验证所含离子所用的试剂是在 .
(2)可用生成的CO2制取优质碳酸钙.制备时,先向氯化钙溶液中通入氨气,再通入CO2 .
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气.某学习小组选取图1所给部分装置制取并收集纯净的氨气.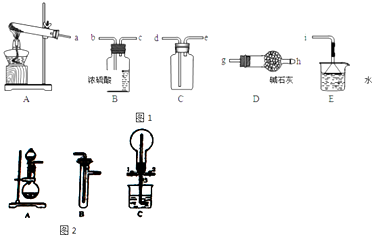
如果按气流方向连接各仪器接口,你认为正确的顺序为a→、→、→i.
其中与i相连漏斗的作用是 .
②为探究氨气和氯气的反应(图2)
a.装置A、B,B装置内的药品依次是、 .
b.装置C可用于探究氯气与氨气(已知氯气和氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应.实验打开开关1、3,关闭2,先向烧瓶中通入 , 然后关闭1、3,打开2,向烧瓶中缓缓通入一定量的另一种气体.实验一段时间后向烧瓶内出现浓厚的白烟并在容器内壁凝结.
(3)测定铜矿石中Cu2(OH)2CO3质量百分含量的方法是:
a.将1.25g铜矿石制取的CuSO45H2O于锥形瓶中,加入适量水完全溶解;
b.向溶液中加入100mL0.25mol/L的氢氧化钠溶液使Cu2+完全沉淀;
c.过滤;
d.滤液中的氢氧化钠溶液用0.5mol/L盐酸滴定至终点,耗用10mL盐酸.则铜矿石中Cu2(OH)2CO3质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将足量的CO2气体不断通人到含KOH,Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.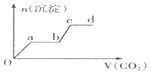
B.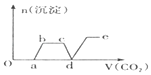
C.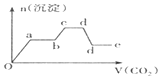
D.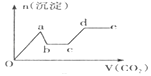
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2 溶液没有白色沉淀产生 D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13C﹣NMR(核磁共振)、15N﹣NMR可用于测定蛋白质、核酸等生物大分子的空间结构。下列有关13C、15N的叙述正确的是( )
A. 13C、15N具有相同的中子数B. 13C与12C60互为同位素
C. 15N的核外电子数与中子数相同D. 15N与14N核外电子排布相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515.20.2g该样品与100mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为( )
A.78
B.140
C.156
D.172
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH . (填“>7”、“<7”、或“无法确定”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com