
下列反应属于氧化还原反应的是( )
A.Na2O+H2O==2NaOH
B.H2+CuO==Cu+H2O
C.CaCO3==CaO+CO2↑
D.KOH+HNO3==KNO3+H2O
科目:高中化学 来源:2016-2017学年贵州省高二上半期考试化学卷(解析版) 题型:选择题
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)  1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平
1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平 衡后,为提高该反应的速率和NO的转化率
衡后,为提高该反应的速率和NO的转化率 ,采取的正确措施是( )
,采取的正确措施是( )
A 加催化剂同时升高温度 B 加催化剂同时增大压强
C 升高温度同时充入N2 D 降低温度同时增大 压强
压强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
变质的油脂有难闻的“哈喇”味,这是因为发生了( )
A.氧化反应 B.加成反应 C.取代反应 D.水解反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
当光束通过下列每组分散系时,不能通过观察丁达尔效应进行区分的是
A.H2SiO3胶体和NACl溶液 B.FeCl3溶液和Fe(OH)3胶体
C.豆浆和蔗糖溶液 D.CuSO4溶液和NA2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中文化学卷(解析版) 题型:选择题
合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)?2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
A.N2、H2完全转化为NH3 B.N2、H2、NH3在容器中共存
C.反应已达到化学平衡状态 D.N2、H2、NH3的浓度不再改变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上期中文化学卷(解析版) 题型:选择题
离子化合物是离子通过离子键结合成的化合物.下列物质属于离子化合物的是()
A H2O B HCl C NaCl D.CO2
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上第二阶段考化学试卷(解析版) 题型:实验题
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示。
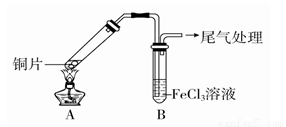
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1, |
FeCl3溶液显酸性的原因是_______________________(用离子方程式表示)。写出装置A中产生SO2的化学方程式:______________________。
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应。将混合液放置12小时,溶液才变成浅绿色。
【资料】[Fe(HSO3)]2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成[Fe(HSO3)]2+离子的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_____________________。
写出溶液中[Fe(HSO3)]2+离子与Fe3+反应的离子方程式:_________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②③的实验。
步骤② | 往5 mL 1 mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO |
用铁氰化钾K3[Fe(CN)6] 溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为______________
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.___________________ ___ _______。
___ _______。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:实验题
硫的化合物在工业上有广泛的应用,因此研究硫的化合物制备有着重要的意义.某同学拟采用下图装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).已知装置图l—II中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5
(l)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为______________;如果想控制反应速度,图2中可选用的发生装置是_______(填写字母).
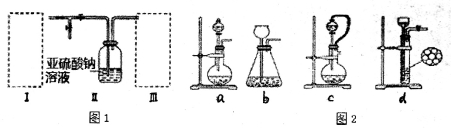
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是________________
(3)装置III用于处理尾气,可选用的最佳试剂是______________(填序号).
a、饱和食 盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液
盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液
(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为___________________
(5)工业制备得到产品Na2S2O5中含有杂质碳酸钠,检验产品中含有碳酸钠杂质所需试剂是___________(填编号)(已知Na2S2O5溶于水即生成NaHSO3)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com