
【题目】实验室用密度为1.25 g·mL-1,质量分数为36.5 %的浓盐酸配制240mL0.1mol ·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________。
(2)配制240 mL 0.1mol·L-1的盐酸应量取浓盐酸体积________mL,应选用容量瓶的规格是________mL.
(3)所需的实验仪器除量筒和容量瓶外还有:________________。
(4)若配制的溶液浓度偏小,则可能的原因是________(填序号)。
①浓盐酸稀释溶解时有溶液溅出
②容量瓶洗净后没有干燥
③定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
④定容时俯视刻度线
【答案】12.5mol.L-1 2 250 胶头滴管,烧杯,玻璃棒 ① ③
【解析】
(1)根据c=![]() 计算浓度;
计算浓度;
(2)根据稀释前后盐酸的物质的量不变计算需要浓盐酸体积;选取容量瓶规格应该等于或稍大于配制溶液体积;
(3)根据具体的操作步骤,选择所需的仪器;
(4)根据c=![]() 判断误差分析,如果n偏大或V偏小都导致c偏大,如果n偏小或V偏大都导致c偏小。
判断误差分析,如果n偏大或V偏小都导致c偏大,如果n偏小或V偏大都导致c偏小。
(1)浓盐酸的物质的量浓度为![]() mol/L=12.5mol/L,
mol/L=12.5mol/L,
因此,本题正确答案是:12.5mol.L-1;
(2)稀释前后盐酸的物质的量不变,浓盐酸体积=![]() =0.002L=2mL;选取容量瓶规格应该等于或稍大于配制溶液体积,实验室没有240mL容量瓶,有250mL容量瓶,所以应该选取250mL容量瓶,
=0.002L=2mL;选取容量瓶规格应该等于或稍大于配制溶液体积,实验室没有240mL容量瓶,有250mL容量瓶,所以应该选取250mL容量瓶,
因此,本题正确答案是:2;250;
(3)配制配制0.1mol·L-1的盐酸250 mL,所以需选用250 mL的容量瓶,量取浓盐酸需要量筒,溶解需要用烧杯,玻璃棒搅拌,转移过程中用玻璃棒引流。最后用胶头滴管定容。
故还需仪器为:胶头滴管,烧杯,玻璃棒,
因此,本题正确答案是:胶头滴管,烧杯,玻璃棒;
(4)根据c=![]() 判断误差分析,如果n偏大或V偏小都导致c偏大,如果n偏小或V偏大都导致c偏小,
判断误差分析,如果n偏大或V偏小都导致c偏大,如果n偏小或V偏大都导致c偏小,
①浓盐酸稀释溶解时有溶液溅出,导致溶质的物质的量偏小,所以配制溶液浓度偏小,应选;
②容量瓶洗净后没有干燥,里面含有少量水,对溶质的物质的量和溶液的体积都没有影响,根据c=![]() 可得,不影响配制结果,不选;
可得,不影响配制结果,不选;
③定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线,导致配制的溶液体积偏大,根据c=![]() 可得,配制的溶液浓度偏低,应选;
可得,配制的溶液浓度偏低,应选;
④定容时俯视刻度线,导致加入的蒸馏水体积偏小,根据c=![]() 可得,配制的溶液浓度偏高,不选;
可得,配制的溶液浓度偏高,不选;
因此,本题正确答案是:① ③。


科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。用含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
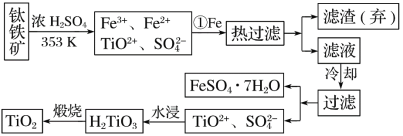
(1)步骤①加Fe的目的是________________________________________________________;步骤②冷却的目的是________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是______________________。
(3)由金红石(TiO2)制取单质Ti,涉及到的步骤为TiO2―→TiCl4![]() Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
Ti,反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,氧化产物与还原产物为同一物质的是
A. Cl2+2NaOH===NaCl+NaClO+H2O
B. MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C. Fe+2HCl===FeCl2+H2↑
D. KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-,ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是
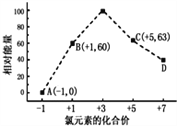
A. ClO2-→ClO3-+ClO4- 可以自发进行
B. A、B、C、D中C最稳定
C. B→A+D反应的活化能为60 kJmol-1
D. B→A+C反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H= -117 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设pC为溶液中粒子物质的量浓度的负对数,即:pC=-lgC。25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。下列说法正确的是
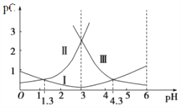
A. 曲线I表明,c(R2-)随着pH增大而逐渐增大
B. pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/L
C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=1000
D. NaHR水溶液中:c(Na+)>c(HR-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SiO4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子排布图是____________________。
②写出与SiO4-具有相同空间构型和键合形式的微粒,分子和离子各写一个_______。
③下图为一种硅氧组群的结构示意图,其离子符号为____,其中Si原子的杂化方式为_____。
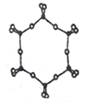
④电负性:Si____O(填“>”、“=”或“<”) 。
(2)2017年,我国科学家又在碳原子研究上获得突破:由中科院大学物理学院苏刚教授等人通过理论计算预言的一种三维碳结构T-碳(T-carbon) 诞生,中外科学家联合研究团队成功合成了T-碳,从而使T-碳成为可与石墨和金刚石比肩的碳的另一种三维新结构。T碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。T-碳属于_____晶体。已知T-碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为_______g/cm3。(写出表达式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 某离子被沉淀完全是指该离子在溶液中的浓度变为0
B. 某物质的溶解性为难溶,则该物质的溶解度为0
C. 一般来说,溶解度小的难溶物容易转化为溶解度大的难溶物
D. 沉淀的生成、溶解和转化其实质都是沉淀发生了溶解平衡的移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不另用任何试剂就能将下列五种溶液:①CuCl2、②Na2SO4、③KCl、④K2CO3、⑤BaCl2鉴别出来,其正确的鉴别顺序是( )
A.①②④③⑤
B.④⑤③②①
C.①④⑤②③
D.①②④⑤③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com