
| n |
| V |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.4mol |
| 0.1L |


科目:高中化学 来源: 题型:
| ||
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成1molNa2CrO4时电子转移3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
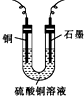 当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示:
当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示: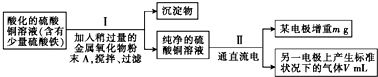
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=
某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 表一 | ||
| T/℃ | 400 | 500 |
| K | 32 | 44 |
| 表二 | |||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量浓度(mol?L-1) | 0.54 | 0.68 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 精制 |
| 电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解熔融的氧化铝制取金属铝,用镁作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )
A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )| A、A、B、C中一定有一种是氧元素的单质 |
| B、D、E中一定都含有A的元素 |
| C、单质B肯定是氧化剂 |
| D、若A是非金属,则B一定为金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com