
在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol•L﹣1,在一定条件下发生反应:A(g)+B(g)⇌2C(g),该温度下,此反应的平衡常数为4,则A的转化率为( )
|
| A. | 20% | B. | 30% | C. | 40% | D. | 50% |
| 化学平衡的计算. | |
| 专题: | 化学平衡专题. |
| 分析: | 依据化学平衡三段式列式计算,设A的转化率为x A(g)+B(g)⇌2C(g) 起始量(mol/L) 2 2 0 变化量(mol/L) 2x 2x 4x 平衡量(mol/L)2﹣2x 2﹣2x 4x 依据平衡常数概念计算列式计算. |
| 解答: | 解:依据化学平衡三段式列式计算,设A的转化率为x A(g)+B(g)⇌2C(g) 起始量(mol/L) 2 2 0 变化量(mol/L) 2x 2x 4x 平衡量(mol/L)2﹣2x 2﹣2x 4x 平衡常数K= 则A的转化率= 故选D. |
| 点评: | 本题考查了化学平衡计算方法和平衡常数、转化率概念计算的分析应用,题目较简单. |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
根据反应 8NH3+3Cl2=6NH4Cl+N2 回答下列问题:
(1)氧化剂是,还原剂NH3.
(2)氧化剂与氧化产物的质量比.
(3)当有68g NH3参加反应时,计算被氧化的物质的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
某离子晶体中,晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
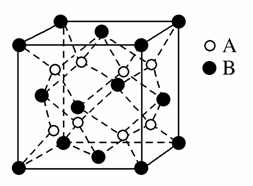
A.B2A B.BA2
C.B7A4 D.B4A7
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2NO2 (g)⇌N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )

|
| A. | 上述过程中,A烧瓶内正、逆反应速率均加快 |
|
| B. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 |
|
| C. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
|
| D. | 反应2NO2(g)⇌N2O4(g)的逆反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
|
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
|
| B. | 合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施 |
|
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
|
| D. | 对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要意义.
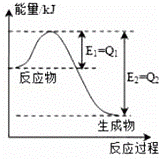
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式: (△H的数值用含字母Q1、Q2的代数式表示).
(2)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)⇌2SO3(g),混合体系中SO3的体积分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题,
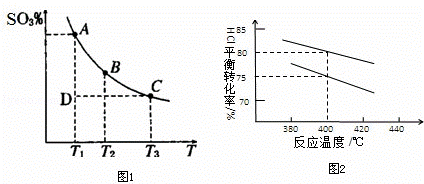
①2SO3⇌2SO2+O2的△H 0.
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;
③反应进行到状态D时,v正 v逆(填<、>或=).
(3)Cl2合成有机物时会产生副产物HC1.4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g)可实现氯的循环利用.
①该反应平衡常数的表达式K= ;若反应容器的容积为2L,4min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L∙min.
②若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 .
a.4v正(HCl)=v逆(O2)
b.又加入1mol O2,达新平衡时,HCl的转化率增大
c.分离出H2O,达新平衡时,v正(HCl)增大
③图2是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1下,反应温度对HCl平衡转化率影响的曲线.下列叙述正确的是 .
a.其他条件不变,升高温度,平衡常数K值增大
b.若平衡常数K值变大,达新平衡前v逆始终减小
c.若平衡常数K值变大,则平衡向正反应方向移动
④投料比为4:1、温度为400℃时,平衡混合物中
Cl2的物质的量分数是 %.(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,实验结果与预测现象不一致的是

| 选项 | 中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)⇌xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

|
| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
|
| B. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
|
| C. | 若x<3,C的平衡浓度关系为:c(M)>c(N) |
|
| D. | x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键的说法错误的是( )
A.如果电子云图象是由两个s电子重叠形成的,即形成ss σ键
B.s电子与p电子可形成sp σ键
C.p电子与p电子不能形成σ键
D.HCl分子里含一个sp σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com