
| A. | 葡萄糖、麦芽糖均能与新制Cu(OH)2反应 | |
| B. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| C. | 当人误食重金属盐时,可喝大量的牛奶、蛋清解毒 | |
| D. | 油脂在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |
分析 A、葡萄糖和麦芽糖均为还原性糖;
B、蛋白质煮沸时不能水解;
C、可溶性重金属盐能使蛋白质变性;
D、汽车洗涤用的液体肥皂的主要成分为硬脂酸钾.
解答 解:A、葡萄糖和麦芽糖均为还原性糖,均含醛基,故均能与新制的氢氧化铜反应生成砖红色沉淀,故A正确;
B、蛋白质煮沸时不能水解为氨基酸,只有在人体内在蛋白酶的作用下才能水解为人体需要的氨基酸,故B错误;
C、可溶性重金属盐能使蛋白质变性,故能使人中毒,而当人误食重金属盐时,可喝大量的牛奶、蛋清等富含蛋白质的物质来替代人体中毒,从而缓解人体解毒,故C正确;
D、汽车洗涤用的液体肥皂的主要成分为硬脂酸钾,是用油脂在KOH溶液中水解制得的,故D正确.
故选B.
点评 本题考查了化学在生活中的应用,应注意的是可溶性重金属盐能使蛋白质变性,即氯化钡能使人中毒,但BaSO4无毒.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 锌片发生氧化反应 | B. | 铜片发生还原反应 | ||
| C. | 铜片上有氢气析出 | D. | 电子从锌片流出,流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | MnO4-… | Cl2、Mn2+… |
| ③ | Cl2、FeBr2 | FeCl3、FeBr3 |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第②组反应中生成lmol Cl2,转移电子5mol | |
| C. | 第③组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
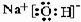 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和CH3CH2CH3 | B. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | ||
| C. | 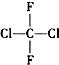 和 和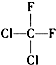 | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
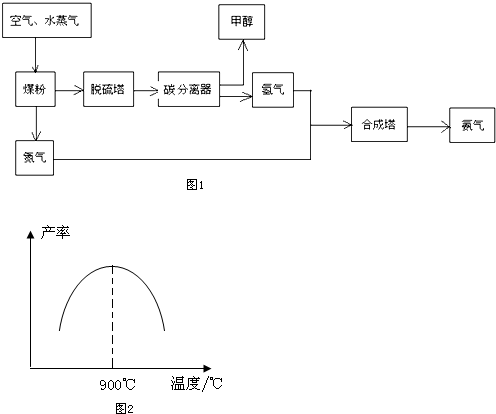
| 物质 | H2 | CO | C H3OH |
| 浓度/(mol•L-1) | 0.20 | o.10 | o.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com