
分析 Al与Na2O2在水中发生的反应分别为:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑;设原混合物中含有Na2O2、Al的物质的量分别为x、y,混合物完全溶解,说明Na2O2、Al都完全反应,根据方程式及“无色透明溶液并放出7g气体”可知:①$\frac{x}{2}$×32g/mol+$\frac{3}{2}$y×2g/mol=7g;
向该溶液中滴加5mol•L-1的盐酸,有白色胶状沉淀生成,当滴加到280mL升时,沉淀恰好溶解,根据反应NaAlO2+4HCl=AlCl3+NaCl+2H2O可知溶质为NaCl、AlCl3,根据氯元素守恒可得:②2x+3y=5mol/L×0.28L,然后联立①②进行计算即可.
解答 解:Al与Na2O2在水中发生的反应分别为:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
设原混合物中含有Na2O2、Al的物质的量分别为x、y,混合物完全溶解,说明Na2O2、Al都完全反应,
根据方程式及“无色透明溶液并放出7g气体”可知:①$\frac{x}{2}$×32g/mol+$\frac{3}{2}$y×2g/mol=7g,
向该溶液中滴加5mol•L-1的盐酸,有白色胶状沉淀生成,当滴加到280mL升时,沉淀恰好溶解,发生反应为:NaAlO2+4HCl=AlCl3+NaCl+2H2O,反应后溶质为NaCl、AlCl3,
根据氯元素守恒可得:②2x+3y=5mol/L×0.28L,
联立①②解得:x=0.4mol、y=0.1mol,
所以混合物铝和过氧化钠的物质的量之比为:0.1mol:0.4mol=1:4,
答:混合物铝和过氧化钠的物质的量之比为1:4.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 同位素的应用已经遍及医学、工业、农业、能源和科学研究的各个领域 | |
| B. | iPhone5外壳易掉色,是因为铝壳表面氧化处理过程中作为阴极的金属铝纯度不够,导致氧化膜不够致密 | |
| C. | 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.60L | B. | 6.72L | C. | 4.48L | D. | 7.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入酸性KMnO4溶液中,溶液的紫色褪去 | |
| B. | 乙烯与乙醇在浓硫酸作用下共热反应生成乙酸乙酯 | |
| C. | 苯与溴水混合振荡,溴水层的颜色变浅 | |
| D. | 苯与氢气在一定条件下反应生成环已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质置换金属单质 | B. | 金属单质置换非金属单质 | ||
| C. | 非金属单质置换金属单质 | D. | 非金属单质置换非金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
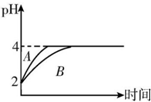 已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:
已知t℃时,0.01mol•L-1NaOH溶液的pH=11,0.1mol•L-1的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=109.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com