
分析 金属钠在700℃~800℃时与四氯化钛(TiCl4)反应制取金属钛,属于置换反应;
在反应中硫酸不足,则镁和铝反应生成的氢气相同.由于钠是活泼的金属,过量的钠能和水继续反应生成氢气.
解答 解:金属钠是活泼的金属,在700℃~800℃时与四氯化钛(TiCl4)反应制取金属钛,该反应的化学方程式为:4Na+TiCl4$\frac{\underline{\;高温\;}}{\;}$4NaCl+Ti,
在反应中硫酸不足,则镁和铝反应生成的氢气相同,由于钠是活泼的金属,过量的钠能和水继续反应生成氢气,所以若过量的相同质量的钠、镁、铝与相同质量分数、相同质量的硫酸溶液反应,产生氢气最多的是钠.
故答案为:4Na+TiCl4$\frac{\underline{\;高温\;}}{\;}$4NaCl+Ti;钠.
点评 本题考查钠的性质、金属与稀硫酸反应的有关计算,侧重对学生基础知识的巩固与训练,旨在培养学生灵活运用基础知识解决实际问题的能力,关键是注意钠能与水反应生成氢气.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
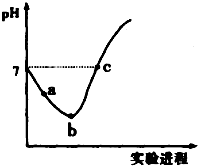 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是( )| A. | 向a 点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| B. | b 点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 由a 点到b 点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$ 减小 | |
| D. | c 点所示溶液中:c(Na+ )=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是配制一定物质的量浓度的溶液的专用仪器 | |
| B. | 容量瓶可以用来加热 | |
| C. | 能用容量瓶贮存配制好的溶液 | |
| D. | 可以用500mL容量瓶配制250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、AlO2-、ClO- | ||
| C. | Fe2+、Na+、Cl-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
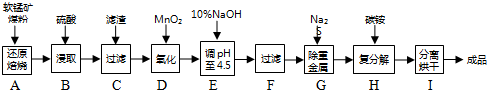
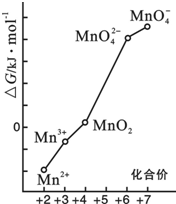
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
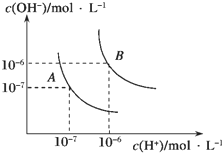
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡正向移动 | B. | (a+b)>(c+d) | C. | X的转化率变大 | D. | Z的体积分数变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com