
对于可逆反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
2SO3(g) ΔH<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )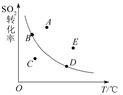
A.A点 B.B、D两点 C.C点 D.E点
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:2013届河南省濮阳市高二上学期期末考试化学试卷 题型:填空题
(16分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g)
△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g)
△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是 。
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO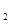 (g)
(g)  2CO(g)平衡常数K的表达式为
;
2CO(g)平衡常数K的表达式为
;
已知C(s)+H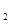 0(g)t
0(g)t CO(g)+H
CO(g)+H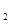 (g)的平衡常数为K1;H
(g)的平衡常数为K1;H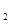 (g)+CO
(g)+CO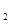 (g)
(g)  C0(g)
C0(g)
+H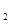 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K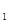 与K
与K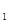 、K
、K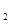 二者的关系为
。
二者的关系为
。
(3)已知某温度下,反应2SO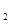 +0
+0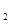
 2S0
2S0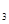 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO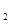 )=lmol·L
)=lmol·L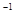 c0(O
c0(O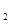 )=1mol·L
)=1mol·L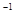 ,当反应在该温度下SO
,当反应在该温度下SO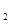 转化率
转化率
为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g)  cC(g)+riD(g)△H=
cC(g)+riD(g)△H=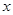 kJ·mol
kJ·mol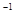 ;若
;若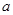 +b>
+b>
c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则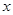 0(填“>”或“<”)。
0(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是 。
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO![]() (g)
(g) 2CO(g)平衡常数K的表达式为 ;
已知C(s)+H![]() 0(g)t
0(g)tCO(g)+H
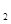 (g)的平衡常数为K1;H
(g)的平衡常数为K1;H![]() (g)+CO
(g)+CO![]() (g)
(g) C0(g)
+H![]() 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K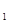 与K
与K![]() 、K
、K![]() 二者的关系为 。
二者的关系为 。
(3)已知某温度下,反应2SO![]() +0
+0![]()
2S0
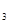 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO![]() )=lmol·L
)=lmol·L![]() c0(O
c0(O![]() )=1mol·L
)=1mol·L![]() ,当反应在该温度下SO
,当反应在该温度下SO![]() 转化率
转化率
为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g) cC(g)+riD(g)△H=
![]() kJ·mol
kJ·mol![]() ;若
;若![]() +b>
+b>
c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则![]() 0(填“>”或“<”)。
0(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省濮阳市高二上学期期末考试化学试卷 题型:填空题
(16分)化学学科中的平衡理论主要内 容包括:化学平衡、电离平衡、水解平衡和
容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是 。
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO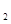 (g)
(g)  2CO(g)平衡常数K的表达式为 ;
2CO(g)平衡常数K的表达式为 ;
已知C(s)+H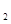 0(g)t
0(g)t CO(g)+H
CO(g)+H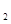 (g)的平衡常数为K1;H
(g)的平衡常数为K1;H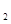 (g)+CO
(g)+CO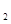 (g)
(g)  C0(g)
C0(g)
+H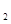 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K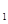 与K
与K 、K
、K 二者的关系为 。
二者的关系为 。
(3)已知某温度下,反应2SO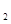 +0
+0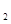
 2S0
2S0 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO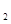 )=lmol·L
)=lmol·L c0(O
c0(O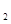 )=1mol·L
)=1mol·L ,当反应在该温度下SO
,当反应在该温度下SO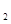 转化率
转化率
为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g)  cC(g)+riD(g)△H=
cC(g)+riD(g)△H=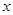 kJ·mol
kJ·mol ;若
;若 +b>
+b>
c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则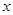 0(填“>”或“<”)。
0(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com