
分析 反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2中,Cl元素的化合价既升高又降低,其中9molCl原子得电子,1molCl原子失电子,O元素的化合价升高,2molO原子失电子,以此来解答.
解答 解:(1)反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2中,9molCl原子得电子,1molCl原子失电子,2molO原子失电子,则氧化剂为4.5mol,还原剂物质的量为0.5mol+2mol=2.5mol,所以氧化剂与还原剂物质的量之比为9:5,故答案为:9:5;
(2)反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2中,5mol氯气反应时,被氧化的氯气为0.5mol,转移电子的物质的量为9mol,则当转移1mol电子时,被氧化的Cl2的物质的量是$\frac{1}{18}$mol,故答案为:$\frac{1}{18}$mol;
(3)每产生1mol O2时,O元素失去4mol电子,则氯元素得到4mol,所以被氧元素还原的氯气物质的量为2mol,故答案为:2 mol;
(4)由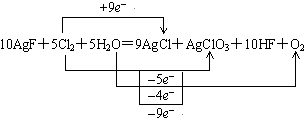 可知,5molH2O参加反应,只有2mol作还原剂被氧化,即反应消耗的水是$\frac{2}{5}$被氧化,故答案为:C.
可知,5molH2O参加反应,只有2mol作还原剂被氧化,即反应消耗的水是$\frac{2}{5}$被氧化,故答案为:C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意判断Cl、O元素的化合价,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
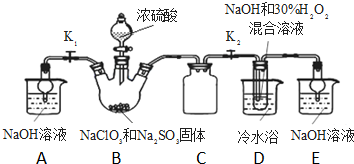 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32- | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和
和 为同一物质③
为同一物质③ 和
和 为同分异构体④O2和O3互为同素异形体⑤
为同分异构体④O2和O3互为同素异形体⑤ 和
和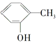 为同系物 ⑥
为同系物 ⑥ 和
和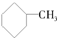 为芳香化合物( )
为芳香化合物( )| A. | ①③④⑥ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
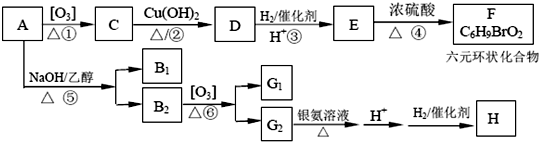
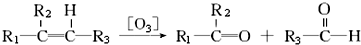
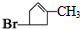 ;B1 的分子式为C6H8.
;B1 的分子式为C6H8.
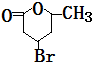 +H2O.
+H2O.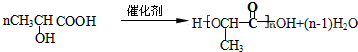 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com