
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
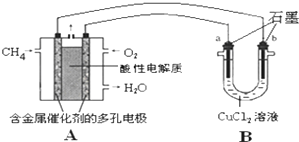
分析 (1)依据热化学方程式和盖斯定律计算[①+②+③×4]×$\frac{1}{2}$得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式;
(2)①依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断,由正逆反应速率相同衍生的关系,变量不变说明反应达到平衡状态;
②20min-30min反应达到平衡,图表中得到平衡浓度,依据平衡常数的概念计算得到;
③依据图表数据变化分析,30min末一氧化氮和二氧化碳浓度减小,氮气浓度增大,结合计算平衡常数和浓度变化分析判断;改变的条件可能是减小二氧化碳浓度;
(3)①甲烷燃料酸性电池中,负极上甲烷失电子生成水和二氧化碳,结合电荷守恒和原子守恒书写电极反应;
②b电极为阴极,阴极上铜离子放电生成Cu,根据Cu和转移电子之间的关系式计算;
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-l
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160kJ•mol-l
③H2O(g)═H2O(l)△H=-44.0kJ•mol-l
依据盖斯定律计算[①+②+③×4]×$\frac{1}{2}$得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ•mol-1;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ•mol-1;
(2)①C(s)+2NO(g)?N2(g)+CO2(g).反应是气体体积不变的反应;
A.容器内CO2的浓度保持不变说明反应达到平衡状态,故A正确;
B.反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,v正(NO)=2v正(N2)z只能说明反应正向进行,故B错误;
C.反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故C错误;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故D正确;
E.混合气体的平均相对分子质量等于气体总质量除以总物质的量,反应中碳是固体,平衡移动,气体质量发生变化,气体物质的量不变,混合气体的平均相对分子质量保持不变,说明反应达到平衡状态,故E正确;
故选BC;
②20-30min反应达到平衡状态,C(s)+2NO(g)?N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.3mol/L;c(NO)=0.4mol/L,反应的平衡常数为:K=$\frac{[C{O}_{2}][{N}_{2}]}{[NO]^{2}}$=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56,故答案为:0.56;
③30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;K=$\frac{[C{O}_{2}][{N}_{2}]}{[NO]^{2}}$=$\frac{0.34×0.17}{0.3{2}^{2}}$=0.56,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度,依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果,故答案为:减小二氧化碳浓度;
(3)①甲烷燃料酸性电池中,负极上甲烷失电子生成水和二氧化碳,电极反应为CH4-8e─+2H2O=CO2+8H+,故答案为:CH4-8e─+2H2O=CO2+8H+;
②A中消耗0.15mol氧气时,O2+2H2O+4e-=4OH-,转移0.6mol电子,b电极为阴极,阴极上铜离子放电生成Cu,Cu2++2e-=Cu,根据Cu和转移电子之间的关系式得析出Cu的质量=$\frac{0.6mol}{2}$×1×64g/mol=19.2g,故答案为:b;19.2;
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学反应速率、化学平衡常数及其化学平衡影响因素和平衡标志的分析判断,数值的处理和判断是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 高纯硅可作计算机芯片的材料 | |
| B. | 洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | Na2SiO3溶液可做木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molH2SO4与0.5molBa(OH)2完全反应所放出的热量,即为中和热 | |
| B. | 加入催化剂,活化分子的百分含量和数目都增大,从而反应速率增大 | |
| C. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| D. | 牺牲阳极的阴极保护法,是根据电解原理防护金属腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的二氯代物有
的二氯代物有 (
( 是苯基,环用键线式表示,C、H原子都未画出)( )
是苯基,环用键线式表示,C、H原子都未画出)( )| A. | 3种 | B. | 4种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )| A. | 脱氢反应的△H<0 | B. | 600 K时,Y点甲醇的v(逆)<v(正) | ||
| C. | 从Y点到Z点可通过增大压强 | D. | 在t1K时,该反应的平衡常数为8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取氯气 MnO2+4HCl(浓)═Mn2++2 Cl-+Cl2+2H2O | |
| B. | 少量的氢氧化钠溶液滴加到足量氯化铝溶液 Al3++4OH-═AlO2-+2H2O | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com