
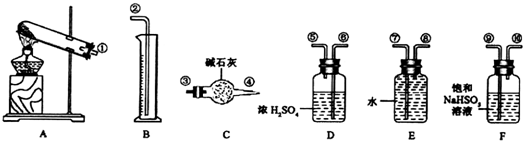
分析 (1)硫酸铜加热分解生成CuO、O2、SO2和SO3气体,根据题中提供的装置和药品可知,实验中用亚硫酸氢钠能吸收三氧化硫,用碱石灰吸收二氧化硫;
(2)根据气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来组装实验仪器;
(3)三氧化硫与亚硫酸氢钠溶液反应生成硫酸钠和二氧化硫;
(4)根据量筒B中水的体积可计算出氧气的物质的量,干燥管C吸收的物质是二氧化硫,二氧化硫包括解热硫酸铜生成的二氧化硫和三氧化硫和水、亚硫酸氢钠反应生成的二氧化硫,通过计算确定生成物之间的物质的量关系,再根据原子守恒确定反应方程式;
解答 解:(1)硫酸铜加热分解生成CuO、O2、SO2和SO3气体,根据题中提供的装置和药品可知,实验中用亚硫酸氢钠能吸收三氧化硫,用碱石灰吸收二氧化硫,所以装置C的作用是 吸收二氧化硫,装置F的作用是吸收三氧化硫,
故答案为:吸收二氧化硫;吸收三氧化硫;
(2)气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来安装实验仪器,按从左至右的方向,先制备气体,通过亚硫酸氢钠吸收三氧化硫,再通过浓硫酸干燥二氧化硫气体和氧气,通过碱石灰吸收二氧化硫称量计算,为防止E中的水蒸气进入C装置,在C后面再连一个D装置,最后利用排水量气法测定氧气的体积,各仪器接口连接顺序为:①⑨⑩⑥⑤③④⑥⑤⑧⑦②;
故答案为:③④⑥⑤⑧⑦;
(3)三氧化硫与亚硫酸氢钠溶液反应生成硫酸钠和二氧化硫,反应方程式为SO3+2NaHSO3=2SO2+Na2SO4+H2O,
故答案为:SO3+2NaHSO3=2SO2+Na2SO4+H2O;
(4)实验后测得装置F总质量比实验前减少了0.96,根据方程式SO3+2NaHSO3=2SO2+Na2SO4+H2O可知,F中吸收的三氧化硫的物质的量为$\frac{0.96}{64×2-80}$mol=0.02mol,同是产生二氧化硫的物质的量为0.04mol,干燥管C吸收的物质是二氧化硫,二氧化硫包括解热硫酸铜生成的二氧化硫和三氧化硫和水、亚硫酸氢钠反应生成的二氧化硫,二氧化硫的物质的量是$\frac{3.84g}{64g/mol}$=0.06mol,所以原分解反应中生成的二氧化硫的物质的量为0.06mol-0.04mol=0.02mol;测得量筒B中水的体积,得出气体在标准状况下的体积为224mL,该气体是氧气,其物质的量是$\frac{0.224L}{22.4L/mol}$=0.01mol,根据硫酸铜中铜元素与硫元素的关系可知,硫酸铜的物质的量为0.02mol+0.02mol=0.04mol,根据铜元素守恒可知,生成的氧化铜的物质的量为0.04mol,所以n(CuSO4):n(CuO):n(SO2):n(SO3):n(O2)=0.04mol:0.04mol:0.02mol:0.02mol:0.01mol=4:4:2:2:1,所以其分解方程式为4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+O2↑+2SO3↑,
故答案为:4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+O2↑+2SO3↑.
点评 本题考查物质的组成和实验数据的处理,做题时注意把握实验基础知识,充分利用有关数据进行计算,本题具有一定难度.


科目:高中化学 来源: 题型:解答题
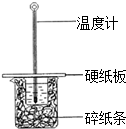 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4 $→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$NgCl2(ag) $\stackrel{电解}{→}$Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$FeCl3(ag) $\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | Cu $\stackrel{稀硝酸}{→}$NO2 $\stackrel{水}{→}$NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的原子L层电子数是K层电子数的2倍 |
| Y | Y是短周期元素中原子半径最大的元素(除稀有气体元素外) |
| Z | Z的原子最外层电子数等于电子层数 |
| W | W原子最外层电子数是X、Z原子最外层电子数之和 |
 ,X的气态氢化物电子式为
,X的气态氢化物电子式为 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2++2OH-═Zn(OH)2↓;ZnCO3+2NaOH═Zn(OH)3↓+Na2CO3 | |
| B. | Ba2++SO42-═BaSO4↓;Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓;AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓;Cu+2AgCl═2Ag+CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com