
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 分子式为C7H6O2 的芳香化合物(只有一个环),该有机物的不饱和度为:$\frac{7×2+2-6}{2}$=5,苯环的不饱和度为4,则该有机物的侧链还含有1个双键,说明该有机物为同碳原子数的一元酸和一元酯,或者为酚羟基苯甲醛,据此进行解答.
解答 解:芳香族化合物的分子式为C7H6O2,其不饱和度为:$\frac{7×2+2-6}{2}$=5,苯环的不饱和度为4,则该有机物的侧链还含有1个双键,
即:苯环的侧链可能连接酯基、羧基或1个羟基和1个醛基,
满足条件的有机物有:苯甲酸、甲酸苯酚酯、邻羟基苯甲醛、间羟基苯甲醛、对羟基醛苯甲醛,
所以满足条件的同分异构体共5种,
故选D.
点评 本题考查了同分异构体的书写方法和类别判断,题目难度不大,注意官能团的类别异构分析书写是解题关键,明确同分异构体的书写原则为解答关键,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
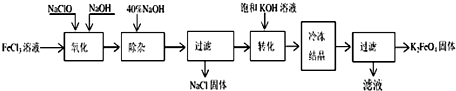
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
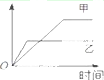 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( ) | 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3═N2+3H2 △H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3 的浓度 | 2个大气压 | 10个大气压 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
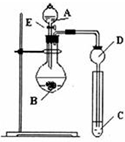 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
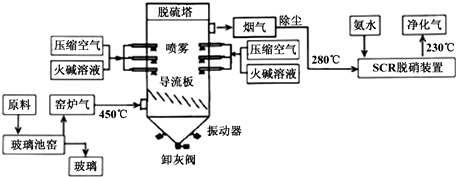
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是一种弱电解质 | |
| B. | 金属钠着火不能用液态二氧化碳灭火 | |
| C. | 二氧化碳和水经“人工树叶”合成燃油,可实现由太阳能转变为化学能 | |
| D. | 用二氧化碳合成可降解的聚碳酸酯塑料,有利于遏制白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c( H+)=1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 在c(OH-):c(H+)=1×1012的溶液:NH4+、Ca2+、C1-、K+ | |
| D. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com