
银器皿日久表面逐渐变黑色,这是由于生成了硫化银(Ag2S)。有人设计用原电池的原理进行“抛光”,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银恢复光泽,且不会损失。试回答:
⑴食盐的作用是______________________。
⑵在此原电池反应中,负极发生的电极反应为__________________________________,正极发生的电极反应为__________________________________。
⑶反应过程中产生臭鸡蛋气味的气体,溶液中发生的反应为2Al3++3S2-+6H2O==2Al(OH)↓+3H2S↑,则原电池总反应方程式为____________________________________________。
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:022
银器皿日久表面逐渐变黑,这是由于生成硫化银.有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失.试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为________;反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| -2 |
| A.反应后溶液的pH降低 | ||
| B.溶液中的OH-离子向正极移动 | ||
C.负极的电极反应式为:2Al+8OH--6e-═2AlO
| ||
| D.正极的电极反应式为:3Ag2S+6e-=═6Ag+3S2- |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省大庆实验中学高二(上)期末化学试卷(解析版) 题型:选择题
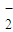 +6Ag+3S2-+4H2O
+6Ag+3S2-+4H2O +4H2O
+4H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com