
����Ŀ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺���ݻ�Ϊ1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��ʵ����CO2��CH3OH(g)�����ʵ���(n)��ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)��ʵ����CO2��CH3OH(g)�����ʵ���(n)��ʱ��仯��ͼ��ʾ��
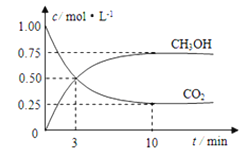
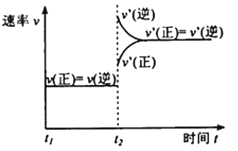
(1)�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=________________����ͼ�Ǹı��¶�ʱ��ѧ��Ӧ������ʱ��仯��ʾ��ͼ����÷�Ӧ������ӦΪ____________��Ӧ������ȡ������ȡ�����
(2)500��÷�Ӧ��ƽ�ⳣ��Ϊ______��������λС������������¶ȵ�800����У���ƽ��ʱ��Kֵ______�����������С�����䡱����
(3)500�������£����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�Ⱦ�Ϊ0.5mol/L�����ʱv(��)______v(��)�����������������=������
(4)���д�ʩ��ʹ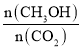 �������______��
�������______��
A�������¶� B����ԭ�����г���1molHe
C����ˮ��������ϵ�з���� D����С�����ݻ�������ѹǿ
���𰸡�0.225mol/(L��min) ���� 5.33 ��С �� CD
��������
��1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽ��֪������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��3��Ϊ2.25mol/L���ٽ��![]() ���㣻�����¶ȶ�ƽ���Ӱ��Ч������
���㣻�����¶ȶ�ƽ���Ӱ��Ч������
��2��ƽ�ⳣ�������������Ũ��ϵ������֮���뷴Ӧ���Ũ��ϵ������֮���ı�ֵ�������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С��
��3�����ݼ���Ũ���̺��¶��µ�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���з���
��4��Ҫ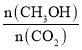 ����Ӧʹƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ�����ѡ���жϡ�
����Ӧʹƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ�����ѡ���жϡ�
��1����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��֪��������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯����3����Ϊ0.75mol/L��3=2.25mol/L����v(H2)=
CH3OH(g)+H2O(g)��֪��������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯����3����Ϊ0.75mol/L��3=2.25mol/L����v(H2)=![]() =0.225mol/(L��mon)������ͼʾ��Ϣ��֪�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����÷�Ӧ������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��0.225mol/(L��min)�����ȣ�
=0.225mol/(L��mon)������ͼʾ��Ϣ��֪�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����÷�Ӧ������ӦΪ���ȷ�Ӧ���ʴ�Ϊ��0.225mol/(L��min)�����ȣ�
��2���ɣ�1����֪ƽ��ʱ����ֵ�Ũ��c(CO2)=0.25mol/L��c(CH3OH)=c(H2O)=0.75mol/L����c(H2)=3mol/L-0.75mol/L��3=0.75mol/L������ƽ�ⳣ��K= =
=![]() =5.3�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ�����С���ʴ�Ϊ��5.3����С��
=5.3�������¶ȣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ�����С���ʴ�Ϊ��5.3����С��
��3�� CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�Ⱦ�Ϊ0.5mol/L����Ũ����Q=![]() =4��K=5.33��˵����Ӧ�������v(��)��v(��)���ʴ�Ϊ������
=4��K=5.33��˵����Ӧ�������v(��)��v(��)���ʴ�Ϊ������
��4��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)Ϊ���������С�ķ��ȷ�Ӧ����
CH3OH(g)+H2O(g)Ϊ���������С�ķ��ȷ�Ӧ����
A���÷�ӦΪ���ȷ�Ӧ���������¶ȣ�ƽ�����淴Ӧ�����ƶ���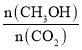 ��С��A�����
����A�����
B. ��ԭ�����г���1 mol He����Ӧ���Ũ�ȱ��ֲ��䣬ƽ�ⲻ�ƶ���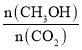 ��ֵ���ֲ��䣬B�����
��ֵ���ֲ��䣬B�����
C. ��ˮ��������ϵ�з������ƽ��������Ӧ�����ƶ���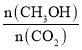 ��ֵ����C����ȷ��
��ֵ����C����ȷ��
D. ��С�����ݻ�������ѹǿ��ƽ��������Ӧ�����ƶ���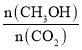 ������D����ȷ��
������D����ȷ��
�ʴ�ΪCD��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ��H
2Fe(s)+3CO2(g) ��H
��1����֪���� Fe2O3(s)+ 3C(ʯī)��2Fe(s)+3CO(g) ��H1�� ��C(ʯī)+CO2(g)��2CO(g) ��H2������H��______���ú���H1����H2����ʽ��ʾ��
��2����¯������Ӧ��ƽ�ⳣ������ʽK��_____________��
��3����T��ʱ���÷�Ӧ��ƽ�ⳣ��K��64���� 2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
Fe2O3 | CO | Fe | CO2 | |
��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�ټ�������CO��ƽ��ת����Ϊ______��
������˵����ȷ����______��
A. ������ѹǿ�㶨����Ӧ�ﵽƽ��״̬ B. �������������ܶȺ㶨����Ӧ��ƽ��
C. ��������CO��ƽ��ת���ʴ����ҵ� D. ����Fe2O3�������CO��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������У���CO�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ������˵����ȷ����
CH3OH(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ������˵����ȷ����

A.CO�ϳɼ״��ķ�ӦΪ���ȷ�ӦB.ƽ�ⳣ��![]()
C.�÷�Ӧ��![]() ʱ��ƽ�ⳣ����
ʱ��ƽ�ⳣ����![]() ʱ��СD.����A��ķ�Ӧ��ϵ��
ʱ��СD.����A��ķ�Ӧ��ϵ��![]() �䵽
�䵽![]() ���ﵽƽ��ʱ
���ﵽƽ��ʱ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W������ԭ��������������Ķ�����Ԫ�أ�W��������������X��������������1����X��Y��Z���һ�ֻ�����(ZXY)2�Ľṹʽ��ͼ��ʾ������˵��������ǣ� ��
![]()
A.Y��W�ļ����ӵİ뾶��С��W��Y
B.Y���������Ӧ��ˮ�������������
C.�⻯��ķе㣺Xһ��С��Z
D.������(ZXY)2������ԭ�Ӿ�����8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NOx���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
I.��֪4CO��g��+2NO2��g��![]() 4CO2��g��+N2��g��H=��1200kJmol��1
4CO2��g��+N2��g��H=��1200kJmol��1
��1���÷�Ӧ��___���������¡����»��κ��¶����������Է����С�
��2�����ڸ÷�Ӧ���ı�ijһ��Ӧ�������¶�T1��T2��������ͼ����ȷ����___�����ţ���

��3��ijʵ��С��ģ�������������̣�һ���¶��£���2L�ĺ����ܱ������У���ʼʱ���ռס������ַ�ʽ����Ͷ�ϡ��ף�NO2 0.2mol��CO 0.4mol���ң�NO2 0.1mol��CO 0.2mol��
����һ��ʱ���ﵽƽ��״̬��
��N2��ƽ�������������___�ң�����������������ȷ��������ͬ����
��NO2��ƽ��Ũ�ȣ���___�ҡ�
�ۼ���CO��ת����Ϊ50%���÷�Ӧ��ƽ�ⳣ��Ϊ___��
II.��������β���е�̼�̣�C����NOx��ͨ��ij���ܴ�������������ͬ�¶��£���ģ��β�����ɷ������ʾ������ͬ������ͨ���ô���������в��CO2��N2��N2O����NO��������ݽ����ͼ��ʾ��

ģ��β�� | ���壨10mol�� | ̼�� | ||
NO | O2 | He | ||
���ʵ�����mol�� | 0.025 | 0.5 | 9.475 | һ���� |
��4��375��ʱ������ų��������к�amol O2��0.0525 mol CO2����֪XΪN2��YΪN2O����a=___��
��5��ʵ������в���NOģ��NOx����������NO2��ԭ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(C9H10O2)����ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȡ����Ʊ�����Ϊ
![]() ��C2H5OH
��C2H5OH![]()
 ��H2O
��H2O
��֪��
���� | ��ɫ��״̬ | �е�(��) | �ܶ�(g��cm-3) | ��Է������� |
������ | ��ɫ��Ƭ״���壻 100���Ѹ������ | 249 | 1.2659 | 122 |
���������� | ��ɫ����Һ�� | 212.6 | 1.05 | 150 |
�Ҵ� | ��ɫ����Һ�� | 78.3 | 0.7893 | 46 |
������ | ��ɫ����Һ�� | 80.8 | 0.7318 | 84 |
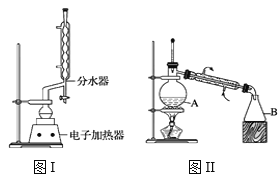
ʵ�鲽�����£�
����100mLԲ����ƿ�м���12.20g�����ᡢ25mL�Ҵ�(����)��20mL�����飬�Լ�4mLŨ���ᣬ��Ͼ��Ȳ������ʯ����ͼI��ʾװ�������������¶���65��70����Ȼ���2h����Ӧʱ�����顪�Ҵ���ˮ���γ�����������(�е�62.6��)��������������÷�ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��������������Ҵ���
�ڷ�Ӧ�������������ų���ˮ����Һ��ر��������������ȣ�����ˮ�����ռ�����Һ�岻���������ӣ�ֹͣ���ȡ�
�۽���ƿ�ڷ�ӦҺ����ʢ������ˮ���ձ��У���������Na2CO3����Һ�����ԡ�
���÷�Һ©���ֳ��л��㣬ˮ����25mL������ȡ��Һ��Ȼ��ϲ��л��㡣�����Ȼ��ƣ��Դֲ�Ʒ��������(װ����ͼII��ʾ)�������������Ѻ�������£�����span>210��213�����֡�
�ݼ���ϸ�ò�Ʒ���Ϊ12.86mL��
��1��������м����ʯ��Ŀ����______��ʹ�÷�ˮ�����Ϸ����ȥˮ��Ŀ����___��
��2��������м������ȵ��¶�Ӧ������____�����ţ���
A.65��70�� B.78��80�� C.85��90�� D.215��220��
��3�����������Na2CO3���벻�㣬�ڲ��������ʱ��������ƿ�пɼ����������ɣ������������ԭ����____��
��4��������з�Һ����������ȷ����___�����ţ���
A.��ʢ��ˮ��ķ�Һ©���м������ѣ��Ǻò�����������Һ©����ת��������
B.���κ����Һ©�����¿ڻ�������
C.���������������ֳַ�Һ©�����ô�Һ��ֲ�
D.Һ��ֲ����Һ©���ϵIJ���������ʹ���ϵİ��۶�©���ϵ�С��
E.��Һ����ʱ����Һ©���е��²�Һ�����¿ڷų���Ȼ���ٽ��ϲ�Һ�����¿ڷų�
��5��ͼII������A��������___����������Ȼ��Ƶ�������___��
��6����ʵ���Ʒ�IJ���Ϊ___�����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ���(��ͼ)�ɵ����ʺͺ�����ɣ������ɺ�������ɣ�������ĵ�������̼�� ��������ͺ���������ɣ�����˵���������
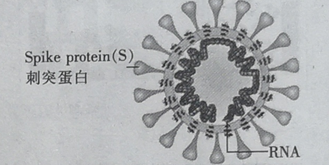
A.�����ʺͺ�����Ǹ߷��ӻ�����
B.�������к�C��H��O��N ��Ԫ��
C.��̼��( C5H10O5)�������ǻ�Ϊͬϵ��
D.NaClO��Һ����������������ΪNaClO ��ʹ�������ױ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M�Ľṹ��ʽΪ  �������й�M���ʵ������д������
�������й�M���ʵ������д������
A��M���������ȫ��Ӧʱ���������ʵ���֮��Ϊ1:2
B��M��̼��������ȫ��Ӧʱ���������ʵ���֮��Ϊ1��1
C��M������������ȫ��Ӧʱ���������ʵ���֮��Ϊ1:2
D��M���������ᷴӦ���������Ҵ���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳƷ�㾫������������·�ߣ���Ӧ������ȥ�����£�
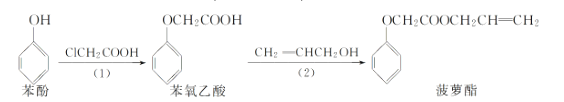
��������������ǣ� ��
A.���裨1�������в����ı��ӿ���![]() ��Һ����
��Һ����
B.���ӺͲ���������������![]() ��Һ������Ӧ
��Һ������Ӧ
C.��������Ͳ�����������![]() ��Һ������Ӧ
��Һ������Ӧ
D.���裨2�������в�����ϩ����������ˮ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com