
| A、C[Na+]>C[CO32-]>C[HCO3-]>C[OH-]>C[H+] |
| B、C[Na+]>C[CO32-]>C[OH-]>C[HCO3-]>C[H+] |
| C、C[Na+]+C[H+]=C[CO32-]+C[OH-]+C[HCO3-] |
| D、C[CO32-]+C[HCO3-]=0.1mol?L-1 |
 HCO3-+OH-;②HCO3-+H2O
HCO3-+OH-;②HCO3-+H2O H2CO3+OH-,其中以第一步水解为主,以此解答该题.
H2CO3+OH-,其中以第一步水解为主,以此解答该题. HCO3-+OH-;②HCO3-+H2O
HCO3-+OH-;②HCO3-+H2O H2CO3+OH-,其中以第一步水解为主,所以C[OH-]>C[HCO3-],故A错误;
H2CO3+OH-,其中以第一步水解为主,所以C[OH-]>C[HCO3-],故A错误; HCO3-+OH-;②HCO3-+H2O
HCO3-+OH-;②HCO3-+H2O H2CO3+OH-,其中以第一步水解为主,所以C[OH-]>C[HCO3-],溶液呈碱性,所以C[OH-]>C[H+],故B正确;
H2CO3+OH-,其中以第一步水解为主,所以C[OH-]>C[HCO3-],溶液呈碱性,所以C[OH-]>C[H+],故B正确;

科目:高中化学 来源: 题型:
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b=c=d |
| B、a>b>d>c |
| C、d>a>c>b |
| D、c>a>b>d |
查看答案和解析>>
科目:高中化学 来源: 题型:
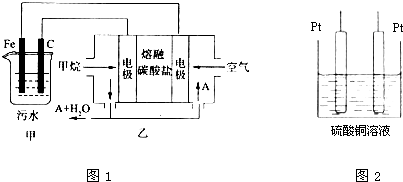
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2B溶液存在:c (Na+)=2c (HB-)+2c(B2-)+2c(H2B) |
| B、NaHB溶液一定显酸性 |
| C、HB-的水解方程式:HB-+H2O?H2B+OH- |
| D、NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+=H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③ | C、③⑥ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大压强,活化分子百分数不变,化学反应速率增大 |
| B、升高温度,活化分子百分数增大,化学反应速率增大 |
| C、加入反应物,活化分子百分数增大,化学反应速率增大 |
| D、使用催化剂,活化分子百分数增大,化学反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com