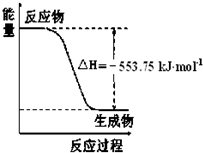
��1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵���
��ЧӦ��ͬ�������ø�˹���ɻش��������⣺
��֪��C
2H
5OH��g��+3O
2��g��=2CO
2��g��+3H
2O��g������H
1=-Q
1 kJ/mol��
C
2H
5OH��g��=C
2H
5OH��l������H
2=-Q
2 kJ/mol��H
2O��g��=H
2O��l������H
3=-Q
3 kJ/mol����ʹ23gҺ̬��ˮ�ƾ���ȫȼ�գ����ָ������£������������зų�������Ϊ
0.5Q1-0.5Q2+1.5Q3
0.5Q1-0.5Q2+1.5Q3
kJ��
��2���������˻����ƻ�潫�й���ͳ�Ļ������˾����Լ��ִ��߿Ƽ���Ϊһ�壮��������ܴ����Դ�ڱ����ȼ�գ�������һ��������ȼ�ϣ��Իش��������⣺
����ͼ��һ����������ȫȼ������CO
2��1mol H
2O��l�������е������仯ͼ����д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ
C3H8��g��+5O2��g��=3CO2��g��+4H2O��l������H1=-2215.0 kJ/mol
C3H8��g��+5O2��g��=3CO2��g��+4H2O��l������H1=-2215.0 kJ/mol
��
�ڽ������Ѿ����Ƴ�����ȼ�ϵ�أ��õ�صĵ������ҺΪKOH��Һ��д���õ�ظ����ĵ缫��Ӧʽ��
C3H8-20e-+26 OH-=3CO32-+17H2O
C3H8-20e-+26 OH-=3CO32-+17H2O
��
��ij���������ԭ������Ϊ52.00����������ص��ý�����һ�ֺ������ε�����ˮ��Һʱ������ÿ�ų� 3360ml����״���������壬������������ 10.4g���ڸú��������н����Ļ��ϼ�Ϊ
+3
+3
���ڸ�ʵ���У�����������������ʧ����������ı��������������
1.32
1.32
g�������ȷ��0.01g����?
�ܶ����ѣ�CH
3OCH
3����һ������ȼ�ϣ�Ӧ��ǰ��������1mol��������ȫȼ������CO
2��Һ̬ˮ�ų�1455kJ��������1mol����Ͷ����ѵĻ��������ȫȼ������CO
2��Һ̬ˮ���ų�1645kJ���������������У�����Ͷ����ѵ����ʵ���֮��Ϊ
1��3
1��3
��




 HCO3-+H+��ƽ�ⳣ��K1=
HCO3-+H+��ƽ�ⳣ��K1= CO32-+H+��HCO3-+H2O
CO32-+H+��HCO3-+H2O H2CO3+OH-��
H2CO3+OH-�� CO32-+H+��HCO3-+H2O
CO32-+H+��HCO3-+H2O H2CO3+OH-��
H2CO3+OH-�� ��1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵���
��1����˹������Ϊ�����ܻ�ѧ������һ����ɻ��������ɣ��������̵���