
| A、27% | B、28% |
| C、37% | D、无法计算 |
| 1 |
| 6 |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
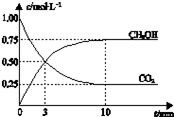 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A、升高温度能使CH3OH增加 |
| B、反应达到平衡状态时,CO2的平衡转化率为75% |
| C、3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D、从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、易被强氧化剂KMnO4等氧化 |
| B、属于不饱和烃易发生加成反应 |
| C、虽然不饱和但比较易发生取代反应 |
| D、苯是一种重要的有机溶剂可广泛应用于生产绿色油漆等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B、加入甲基橙试液呈红色的溶液 NH4+,K+,SO42-,Cl- |
| C、Na2S溶液中 SO42-、K+、Cl-、Cu2+ |
| D、pH=12的溶液中 NO3-、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有I-,不能确定是否含有Cl- |
| B、可能含有NO3-、Cl-和I- |
| C、可能含有NO3- |
| D、一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属单质燃烧时火焰均为无色 |
| B、焰色反应均应透过蓝色钴玻璃观察 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、所有金属及其化合物灼烧时火焰均有颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | 氢氧化铝具有弱碱性 | 可用于制胃酸中和剂 |
| C | 漂白粉在空气中不稳定 | 可用于漂白纸张 |
| D | 氧化铁能与酸反应 | 可用于制作红色涂料 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
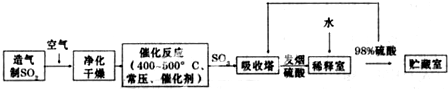
| 氧气 |
| 热空气或 |
| 水蒸气 |
| 碱液 |
| 吸收 |
| 酸化 |
| 蒸馏 |
| 煅烧 |
| 水 |
| 海水 |
| 过滤 |
| 灼烧 |
| 熔化 |
| 电解 |
| 放电 |
| 水 |
| 吸收 |
| 一定条件下 |
| 合成塔 |
| 过量氯气 |
| 水冷 |
| 分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com