
如下图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
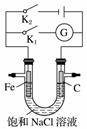
A.K1闭合,铁棒上发生的反应为2H++2e-—→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
科目:高中化学 来源: 题型:
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成
C.放电时OH-向正极移动 D.总反应为:2Li+2H2O === 2LiOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡状态Ⅰ、Ⅱ、Ⅲ的相关数据如下表:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979 K | 1 173 K | |||
| Ⅰ | Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)FeO(s)+H2(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是( )
A.a>b
B.增大压强,平衡状态Ⅱ不移动
C.升高温度,平衡状态Ⅲ向正反应方向移动
D.反应Ⅰ、Ⅲ均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
两个惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计),电极上析出银的质量最大为( )
A.27 mg B.54 mg C.106 mg D.216 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
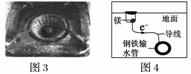
下列与金属腐蚀有关的说法,正确的是( )
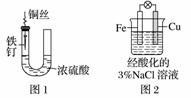
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
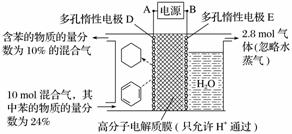
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是
A.元素X:它的原子中M层比L层少2个电子
B.元素Z:位于元素周期表中的第三周期第ⅢA 族
C.元素Y:它的二价阳离子核外电子总数与氩原子相同
D.元素W:它的焰色反应颜色呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式______。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。该过程中发生反应的离子方程式是____________________________________________________________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com