
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
分析 A、求出镁的物质的量,然后根据镁变为+2价来分析;
B、氢气由氢原子构成;
C、1mol氯化镁中含2mol氯离子;
D、求出氨气的物质的量,然后根据氨气中含10个电子来分析.
解答 解:A、2.4g镁的物质的量为0.1mol,而镁变为+2价,故0.1mol镁失去0.2NA个电子,故A错误;
B、氢气由氢原子构成,故2g氢气中含有的氢原子的物质的量为2mol,个数为2NA个,故B错误;
C、1mol氯化镁中含2mol氯离子,故1mol氯化镁溶于水后溶液中的氯离子的个数为2NA个,故C错误;
D、17g氨气的物质的量为1mol,而氨气中含10个电子,故1mol氨气中含10NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
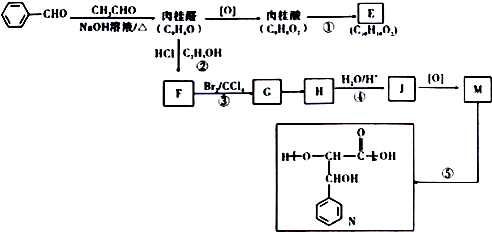
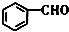 的名称是苯甲醛.
的名称是苯甲醛.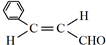 ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面. .
.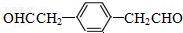 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成氨的工业生产中,使用较高温度有利于提高产量 | |
| B. | 在合成氨的工业生产中,加压有利于提高氨的产量 | |
| C. | 木炭粉碎后与O2反应,速率更快 | |
| D. | 由H2(g)、I2(g)、HI气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
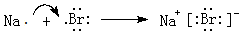 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 2HCl(g)═H2(g)+Cl2(g)△H=183 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=91.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢 | |
| B. | 分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少 | |
| C. | 分别配成溶液,加入澄清石灰水,比较是否有沉淀生成 | |
| D. | 分别将等质量的白色粉末加热,将产生的气体通入澄清石灰水中看是否变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com