
| A、能量守恒原理 | B、泡利原理 |
| C、洪特规则 | D、构造原理 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
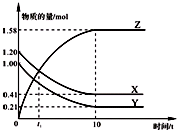 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A、反应开始到10 s,用Z表示的反应速率为0.158 mol/(L?s) |
| B、反应开始到10 s时,Y的转化率为79.0% |
| C、t1时,Z和X的浓度相等,达到了化学平衡状态 |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol CH4(g)和2mol O2(g)的能量总和小于1mol CO2(g)和2mol H2O(g)的能量总和 |
| B、标准状况下,44.8L NO与22.4L O2混合后气体中分子总数小于2NA |
| C、1mol Fe在氧气中充分燃烧失去3NA个电子 |
| D、在标准状况下,NA个CHCl3分子所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一元素的单质,不可能既能与酸反应,又能与碱反应 |
| B、IA族元素的金属性一定比IIA族元素的金属性强 |
| C、第三周期元素的最高正化合价等于它所处的主族序数 |
| D、短周期中,同周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量NO3-的溶液中:Na+、OH-、I-、SO32- |
| B、pH<7的溶液中:Cu2+、Fe3+、NO3-、Cl- |
| C、使石蕊试液变蓝的溶液中:K+、SO32-、S2-、CO32- |
D、c( )=0.1mol/L的溶液中:Na+、Fe3+、SO42-、NO3- )=0.1mol/L的溶液中:Na+、Fe3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑦⑧ | B、③④⑤⑥⑦ |
| C、①④⑤⑥⑦⑧ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | ||||
| B、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | ||||
| C、向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | ||||
D、以铜为电极电解饱和食盐水:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z为短周期元素,在周期表中位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、通常情况下四种元素的单质中,X化学性质最稳定 |
| B、四种元素都能与氢元素形成稳定的化合物 |
| C、Y、Z离子最外层电子数相同 |
| D、四种元素中Z元素最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com