
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。已知25℃,101kPa时:4Fe(s)+3O2(g)
=2Fe2O3(s)ΔH=-1648kJ/mol,C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol,2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol,FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______。
(2)一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题:
①达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____(填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
②达到平衡后,在恒压条件下,向容器中通人氦气(He),氮气的转化率将___(填“增大”、“减小”或“不变”)。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
【答案】4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=﹣260kJmol﹣1向正反应方向不变减小Al2O33HCO3-+Al3+=Al(OH)3↓+3CO2↑
【解析】
(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(2)①该反应的正反应是一个反应前后气体体积减小的反应,增大压强,平衡向气体体积减小的方向移动;温度不变,平衡常数不变;
②达到平衡后,在恒压条件下,向容器中通入氦气,参加反应的气体分压减小,平衡向气体体积增大方向移动.
(3)AlCl3水解生成盐酸挥发,生成氢氧化铝分解生成氧化铝;NaHCO3与Al2(SO4)3溶液混合后铝离子水解呈酸性,碳酸氢根离子水解呈碱性。
(1)已知25℃,101kPa时:①4Fe(s)+3O2(g)=2Fe2O3(s)ΔH=-1648kJ/mol,②C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol,③2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol,根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ·mol-1-2×(-1480kJ·mol-1)+4×(-393kJ·mol-1)=-260kJ·mol-1,故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ·mol-1;
(2)①该反应的正反应是一个反应前后气体体积减小的反应,增大压强,平衡向气体体积减小的方向移动,向正反应方向移动;温度不变,平衡常数不变,所以该反应平衡常数不变。
②达到平衡后,在恒压条件下,向容器中通入氦气,参加反应的气体分压减小,平衡向气体体积增大方向移动,所以逆向移动,氮气的转化率减小。
(3)AlCl3水解生成盐酸挥发,生成氢氧化铝分解生成氧化铝;将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂是利用二者发生双水解生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,相关说法正确的是
A.  如果MnO2过量,浓盐酸就可全部被消耗
如果MnO2过量,浓盐酸就可全部被消耗
B.  量筒中发生了取代反应
量筒中发生了取代反应
C. 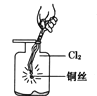 生成蓝色的烟
生成蓝色的烟
D.  湿润的有色布条褪色说明了Cl2具有漂白性
湿润的有色布条褪色说明了Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列状态的氯中,电离最外层一个电子所需能量最大的是( )
A.[Ne]3s1B.[Ne]3s23p5C.[Ne]3s23p3D.[Ne]3s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D.将水加热,Kw增大,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )

A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中,正确的是
A. 一定温度下,向0.1mol/L的氨水中滴加相同浓度的醋酸,c(NH4+)/c(NH3·H2O) 减小
B. 已知Ksp(BaSO4) = 1.1×10—10, Ksp(BaCO3) = 2.58×10—9,所以不能将BaSO4转化为BaCO3
C. 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂
D. 配制FeCl3溶液时,为了抑制水解,可加入少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是

A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+) = c(CH3COO-)
C. c点时:c(OH-) =c(CH3COOH) + c(H+)
D. d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期M、N两种元素对应的简单离子分别为mMa+、n Nb-,若离子的核外电子排布相同,则下列关系不正确的是( )
A. 原子半径:M < NB. 离子半径:M < N
C. 原子序数:M > ND. 主族序数:M < N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com