
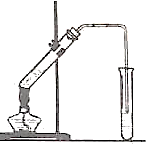
 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.分析 (1)醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水;
(2)浓硫酸做酯化反应的催化剂和吸水剂;
(3)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体;
(4)乙酸和乙醇易挥发;加入可以促使合成乙酸乙酯的反应向右进行;
(5)乙酸乙酯和Na2CO3溶液互不相容,用分液漏斗分离即可;
(6)乙酸乙酯密度小于水,有香味.
解答 解:(1)醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(2)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作酸、催化剂和吸水剂,
故答案为:催化剂、吸水剂;
(3)酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,降低乙酸乙酯的溶解度,使乙酸乙酯难溶于饱和碳酸钠溶液,便于分层,
故答案为:吸收乙酸、溶解乙醇、降低乙酸乙酯的溶解度;
(4)反应开始时,用酒精灯对左试管小火加热是为了防止反应物未来得及反应而挥发损失;反应开始时,用酒精灯对左试管小火加热可以蒸出生成的乙酸乙酯,使可逆反应向右进行,故答案为:防止反应物未来得及反应而挥发损失;蒸出生成的乙酸乙酯,使可逆反应向右进行;
(5)乙酸乙酯和Na2CO3溶液互不相溶,用分液漏斗分离即可,故答案为:分液;分液漏斗;
(6)乙酸乙酯密度小于水,有香味,故答案为:小;芳香.
点评 本题考查乙酸乙酯的制备和物质的检验和除杂,题目难度不大,本题注意把握乙酸乙酯的制备原理和实验方法,学习中注重实验评价能力的培养.


科目:高中化学 来源: 题型:选择题
| A. | Q2>2 Q1 | B. | Q1=92.4 kJ | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A. 玻璃棒 B. 胶头滴管 C. 试管 D. 漏斗
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
已知:C(s)+H2O(g)===CO (g) +H2 (g) ΔH=a kJ·mol-1
2C(s)+ O2(g)===2CO (g) ΔH= - 220 kJ·mol-1
H-H、O==O和O- H键的键能分别为436、496和462 kJ·mol-1,则 a 为
H键的键能分别为436、496和462 kJ·mol-1,则 a 为
A.-332 B.+130 C.+350 D.-118
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
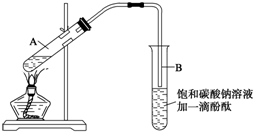 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
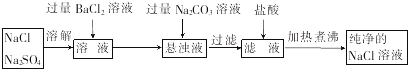
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com