
分析 5min末生成3molZ,v(Z)=$\frac{\frac{3mol}{2L}}{5min}$=0.3mol•(L•min)-1,以W的浓度变化来表示的反应速率为0.2mol•(L•min)-1,由反应速率之比等于化学计量数之比可知,$\frac{0.3}{0.2}=\frac{3}{n}$,解得n=2,则
X(g)+2Y(g)=3Z(g)+2W(g),
开始 4 6 0 0
转化 1 2 3 2
5min 3 4 3 2
结合c=$\frac{n}{V}$、v=$\frac{△c}{△t}$计算.
解答 解:5min末生成3molZ,v(Z)=$\frac{\frac{3mol}{2L}}{5min}$=0.3mol•(L•min)-1,以W的浓度变化来表示的反应速率为0.2mol•(L•min)-1,由反应速率之比等于化学计量数之比可知,$\frac{0.3}{0.2}=\frac{3}{n}$,解得n=2,则
X(g)+2Y(g)=3Z(g)+2W(g),
开始 4 6 0 0
转化 1 2 3 2
5min 3 4 3 2
(1)5min末时X的浓度为$\frac{3mol}{2L}$=1.5mol/L,Y的浓度为$\frac{4mol}{2L}$=2mol/L,
答:5min末时X、Y的浓度分别为1.5mol/L、2mol/L;
(2)前5min内用X的浓度变化表示的平均反应速率为$\frac{\frac{1mol}{2L}}{5min}$=0.1mol•(L•min)-1,
答:X的浓度变化表示的平均反应速率为0.1mol•(L•min)-1;
(3)由上述分析可知化学方程式中n=2,答:n的值为2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铁是人体健康、植树生长所必须的元素之一,缺铁时可用补充FeSO4的方法补铁 | |
| B. | 在采煤作业中,把炸药和干冰放在一起,既能增强爆炸威力,又能防止火灾 | |
| C. | 氢氧燃料电池已用于航天飞机,燃料电池的能量转化率理论上可达100% | |
| D. | 聚乙烯塑料可用于制作餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
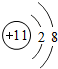 ;
;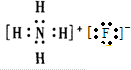 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 变成血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入K3[Fe(CN)6],振荡 | 产生蓝色沉淀 | 存在Fe2+ |
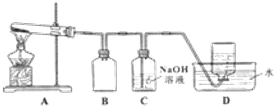
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硫酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g N2和32g O2 | B. | 34g NH3 和4g H2 | ||
| C. | 2LCO2和2LH2O | D. | 11.2LO2和0.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
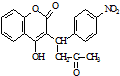
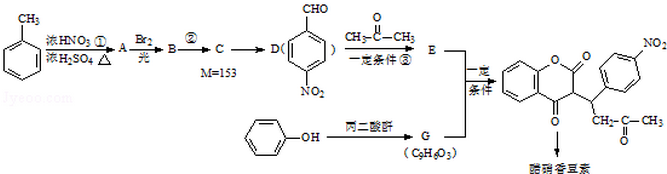 已知:R1-CHO
已知:R1-CHO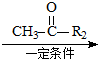 R1-CH=
R1-CH= +H2O
+H2O ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.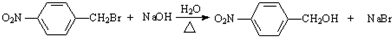 .
.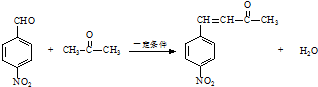 .
.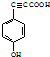 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com