
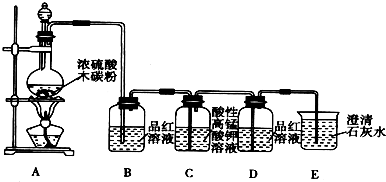
分析 碳和浓硫酸在加热条件下反应生成SO2和CO2,装置B中品红溶液用于检验产物SO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,装置C酸性高锰酸钾溶液用于吸收SO2,装置D中品红溶液用于检验SO2是否除干净,装置E澄清石灰水用于检验产物CO2.
(1)碳单质和浓硫酸在加热条件下反应生成SO2和CO2、水;
(2)装置B中品红溶液用于检验产物SO2,SO2具有漂白性,可以使品红溶液褪色;
(3)酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净;
(4)装置E中澄清的石灰水变浑浊,说明产物中一定存在CO2气体,CO2和氢氧化钙反应生成碳酸钙沉淀.
解答 解:碳和浓硫酸在加热条件下反应生成SO2和CO2,装置B中品红溶液用于检验产物SO2,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,装置C酸性高锰酸钾溶液用于吸收SO2,装置D中品红溶液用于检验SO2是否除干净,装置E澄清石灰水用于检验产物CO2.
(1)碳单质和浓硫酸在加热条件下反应生成SO2和CO2、水,反应方程式为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+2SO2↑+CO2↑;
(2)装置B中品红溶液用于检验产物SO2,SO2具有漂白性,可以使品红溶液褪色,故答案为:品红褪色;漂白性;
(3)二氧化硫具有还原性,酸性高锰酸钾具有强氧化性,可以氧化二氧化硫,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,防止SO2干扰CO2的检验,故答案为:还原性;甲;
(4)装置E中澄清的石灰水变浑浊,说明产物中一定存在CO2气体,CO2和氢氧化钙反应生成碳酸钙沉淀,反应为:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:产生白色的沉淀;CO2+Ca2++2OH-=CaCO3↓+H2O.
点评 本题考查了浓硫酸的强氧化性,侧重于SO2和CO2性质的比较,SO2和CO2均能使澄清石灰水变浑浊,因此在用澄清石灰水检验CO2之前必须把SO2吸收干净,题目有利于培养学生的良好的科学素养,提高学生学习实验的积极性,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X是负极 | B. | Y是正极 | C. | Y极发生还原反应 | D. | Y极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- | |
| D. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
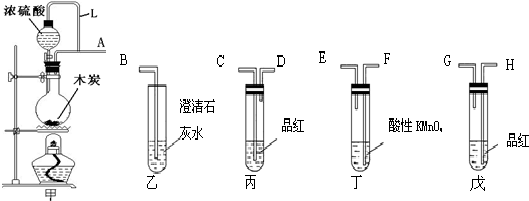
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
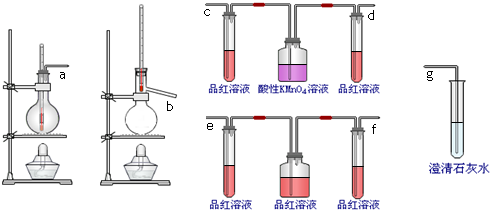
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

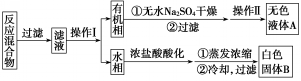
| 序号 | 实验方案 | 实验现象 | 结果 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水洗涤2~3次后再使用 | |
| B. | 用滤纸擦干后才可使用 | |
| C. | 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 | |
| D. | 用盐酸洗涤后,经蒸馏水冲洗,方可使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com