
A.平衡后氨气的分解率为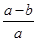 ×100% ×100% |
B.平衡混合气体中H2的体积分数为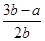 ×100% ×100% |
C.反应前后气体的密度比为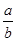 |
D.平衡后气体的平均摩尔质量为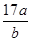 g g |
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源:不详 题型:填空题
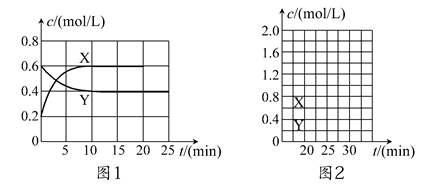
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Q(g)+nR(g),达到平衡后,容器内的压强比原来增加5%,X浓度减小
2Q(g)+nR(g),达到平衡后,容器内的压强比原来增加5%,X浓度减小 ,则该反应方程式中的n值是( )
,则该反应方程式中的n值是( )| A.3 | B.4 | C.5 | D.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
| A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B.若x∶y=1∶2,则平衡时,M中的转化率:A>B |
| C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v正<v逆 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)=AgI(s)+ Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH="-196" kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g),5 min后达平衡,已知各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A 的转化率没有发生变化,则B的转化率为( )
C(g)+D(g),5 min后达平衡,已知各物质的平衡浓度的关系为ca(A)·c(B)=c(C)·c(D)。若在温度不变的情况下,将容器的体积扩大为原来的10倍,A 的转化率没有发生变化,则B的转化率为( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CdS(s)+2H+(aq) ΔH<0
CdS(s)+2H+(aq) ΔH<0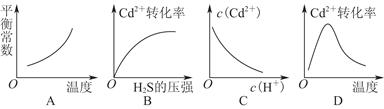
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列: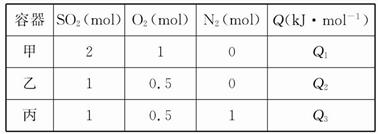
| A.在上述条件下反应生成1 mol SO3固体放热Q/2 kJ | B.2Q3<2Q2=Q1<Q |
| C.Q1=2Q2=2Q3=Q | D.2Q2=2Q3<Q1<Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com