

分析 (1)图中数据表示元素原子得电子的能力,数据越大说明越易得到电子,越易形成阴离子;
(2)g为1.61,d为3.44,相差1.83,a为0.98,h为2.58,相差1.60,根据两元素数据值差大于1.7时,形成离子键,小于1.7时形成共价键判断;
(3)f为镁,12号元素,据此书写电子排布式,根据电子最后填入的能级判断元素的分区.
解答 解:(1)图中数据表示元素原子得电子的能力,数据越大说明越易得到电子,越易形成阴离子,故答案为:易;
(2)g为1.61,d为3.44,相差1.83,形成离子键;a为0.98,h为2.58,相差1.60,形成共价键,故答案为:离子键;共价键;
(3)f为镁,12号元素,电子排布式为1s22s22p63s2,c为N元素,电子最后填入的能级为p,故为p区元素,故答案为:1s22s22p63s2;p.
点评 本题主要考查元素的性质,明确表格的数值与非金属性的关键是解答本题的关键,较好的考查学生对表格中的数据分析整合、处理应用的能力,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:多选题
| A. | 酒精在氧气中燃烧 | B. | 在硫酸中加入铝粉 | ||
| C. | 将二氧化碳气体通入烧碱中 | D. | 向盐酸中加入铁钉 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将实验完剩余的金属钠放回原试剂瓶中 | |
| B. | 测定熔融氢氧化钠的导电性,可在铁质坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 制备Fe(OH)3胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色时停止加热 | |
| D. | 在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,溶液质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
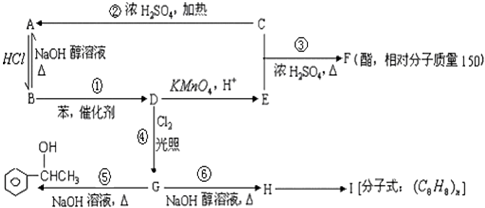
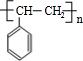
 ;③
;③ +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O;⑥
+H2O;⑥ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘是人体必需微量元素,所以应多吃富含高碘酸的食物 | |
| B. | “血液透析”运用了胶体的性质 | |
| C. | 过氧化钠可作为高空飞行或潜水装置中的供氧剂 | |
| D. | 大力开发太阳能、风能、水能等新能源,减少煤、石油等化石燃料的使用,有利于实现“低碳经济” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它具有+2、+4价 | D. | 它的最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为C的氢化物分子内含有氢键,所以比E的氢化物稳定 | |
| B. | 过量F与氯气加热完全反应,得到相应的低价态氯化物 | |
| C. | 因为E单质相对分子量小于溴单质的相对分子量,所以E单质熔点比溴低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 食物 | 苹果 | 葡萄 | 玉米 | 牛奶 |
| pH | 2.9~3.3 | 3.5~4.5 | 6.8~8.0 | 6.3~6.6 |
| A. | 玉米 | B. | 苹果 | C. | 葡萄 | D. | 牛奶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com