
| A、平衡向正反应方向移动了 |
| B、物质 B 的转化率减小了 |
| C、化学计量数:m+b<p |
| D、物质 C 的质量分数增加了 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
| A、CO过量 |
| B、CO与铁矿石接触不充分 |
| C、炼铁高炉的高度不够 |
| D、CO与的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于非金属性B>D,则A、B组成化合物的沸点高于A、D组成的化合物 |
| B、在C、B形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C、原子半径由大到小排列的是:C>D>E>B>A |
| D、B、C、E三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | Ba(OH)2的体积/mL | 溶液的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
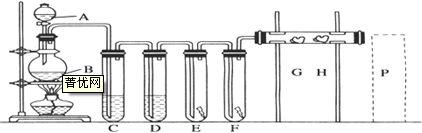
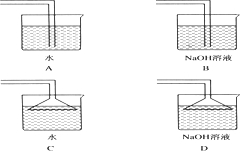
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com